Механизм конверсии смеси CH4 + CO2Статьи / Сравнительный анализ: методы получения синтез-газа / Механизм конверсии смеси CH4 + CO2Страница 2
На катализаторе Ru/SiO2, поскольку SiO2 является довольно инертным носителем, вся реакция CH4 + CO2 протекает на фазе Ru. Быстрое отравление катализатора вызвано образованием промежуточного
углерода, склонного к полимеризации и дальнейшей графитизации. В случае реакции на Ru/C носитель-графит собирает частички CHx, что уменьшает время жизни образующегося углерода на Ru и обусловливает
очень высокую стабильность этого катализатора. В реакции на Ru/Al2O3 участвуют также группы AlOH, подпитываемые спилловером адсорбированных частиц H и O с Ru, что ограничивает дезактивацию катализатора.
В общем случае на Ru-фазе нанесенных рутениевых катализаторов протекают необратимая диссоциация CH4 и следующие процессы:
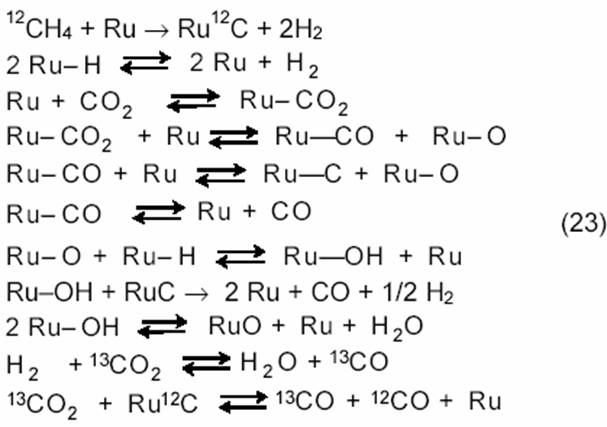
Последнее уравнение показывает, что обе молекулы СО образуются в одной реакции на катализаторе Ru/SiO2, но имеют разное происхождение.
На Ru/Al2O3 протекают еще реакции с участием AlOH-групп:
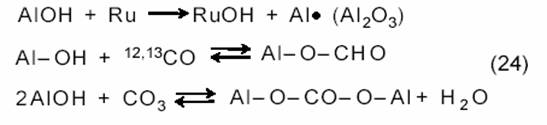 |
К выводу о простом механизме со стехиометрическим разложением СН4 на основании импульсных измерений приходят также в работах [13, 14]. Однако здесь следует иметь в виду, что импульсный метод может и не выявить образования частиц СНх, которые принимаются большинством авторов как промежуточные. Есть данные [15], что на нанесенных Ni-катализаторах число оборотов для разложения СН4 на С и Н2 много ниже, чем для конверсии СН4 с СО2.
Более сложная картина наблюдается в случае реакции на Ni/La2O3. Как показывает метод изотопного обмена, молекулы 13СО и 12СО получаются при взаимодействии СН4 и СО2 с катализатором:
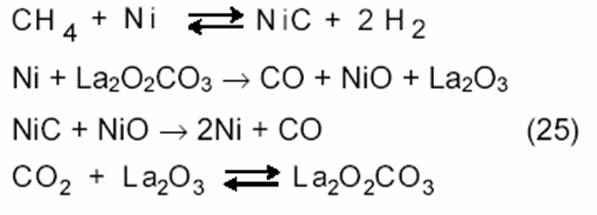 |
На металлах, нанесенных на оксид с основными свойствами, реакция протекает на границе металл-оксид, причем метан диссоциирует на металлической поверхности, а СО2 образует карбонат на носителе. Таким образом, катализатор Ni/SiO2 является монофунциональным, а катализатор Ni/La2O3 ─ бифункциональным.
Методы ТАР-реактора и ИК-спектроскопии показали, что интенсивность линий СО2 после впуска смеси СО2 + СН4 на Rh/γ-Al2O3 проходит через максимум, а затем образуется СО32─, так что механизм с участием реакции Будуара весьма вероятен.
Методы ТАР-реактора и ИК-спектроскопии применили также для исследования конверсии смеси СН4+СО2 на катализаторах ZrO2 и Pt/ZrO2. Установлено, что селективность образования СО определяется одним и тем же промежуточным веществом и зависит от содержания атомарного кислорода на каталитической поверхности. Оксид ZrO2 ответственен за активацию СО2, он частично восстанавливается и реокисляется в условиях реакции. Замещение решеточного кислорода в ZrO2 кислородом из СО2 ─ медленная стадия процесса. После импульса СО2 единственными регистрируемыми частицами, которые остаются достаточно долго на поверхности, являются поверхностные ОН-группы. Очевидно, Оадс после активации СО2 реагирует с метаном. Природа Оадс неясна, это могут быть и реакционноспособные ОН- или СО3-группы. Метан не диссоциирует на ZrO2, но диссоциирует на Pt/ZrO2.
Катализатор Pt/ZrO2 активнее, чем платина на других носителях. Возможно, при этом образуется сплав Pt1─xZr. Предложена следующая схема механизма конверсии на Pt/ZrO2:
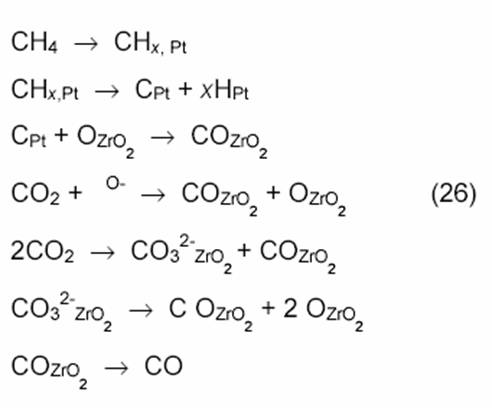
Еще в одной работе с использованием метода ТАР-реактора [18] показано, что не атомы О, а поверхностные ОН-группы реагируют с поверхностными частицами С или СНх:
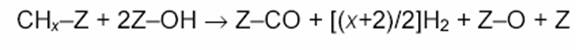 |
Однако в большинстве работ ключевыми промежуточными частицами считают адсорбированные атомы кислорода. В работе [13] предполагается корреляция скорости образования СО в смешанной конверсии СН4+СО2+Н2О с прочностью связи металла с Оадс. Такую корреляцию нельзя считать достоверной и даже если она существует, это еще не доказывает, что атомы Оадс являются ключевыми интермедиатами.
Смотрите также
Технологические и экономические аспекты производства диметилового эфира терефталевой кислоты
ДИМЕТИЛОВЫЙ
ЭФИР ТЕРЕФТАЛЕВОЙ КИСЛОТЫ, ДИМЕТИЛТЕРЕФТАЛАТ, ТЕРЕФТАЛЕВАЯ КИСЛОТА, СПОСОБЫ
ПРОИЗВОДСТВА, ПАРАКСИЛОЛ, РЕКТИФИКАЦИЯ, ЦЕЛЕВОЙ ПРОДУКТ, ПОБОЧНЫЕ ПРОДУКТЫ,
СЕБЕСТОИМОСТЬ ПРОИЗВОДСТВ ...
Введение
Комплексные
фториды многих редких металлов интересны как по своей структуре и свойствам,
так и в качестве материалов для развития многих направлений новой техники.
Примерами могут служить фротоцир ...
