Механизм конверсии смеси CH4 + CO2Статьи / Сравнительный анализ: методы получения синтез-газа / Механизм конверсии смеси CH4 + CO2Страница 1
В большинстве предлагаемых механизмов углекислотной конверсии метана рассматривается диссоциативная адсорбция метана и СО отличающаяся от схемы (11) отсутствием стадии взаимодействия СНх с водой [15]. Предполагается последовательная диссоциация СН4 на поверхности образованием частиц СНх и С и их взаимодействие адсорбированным атомом О, а не с водой. Эти процессы отражает схема:
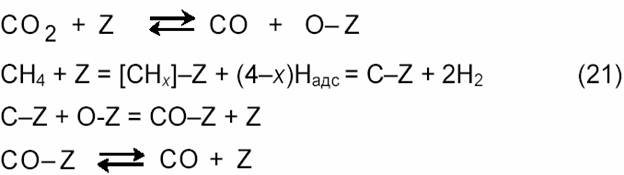 |
Диоксид углерода может также непосредственно реагировать с поверхностным углеродом по реакции, обратной реакции Будуара (9). По данным [18] диссоциация метана на никеле протекает преимущественно на малых кристалликах металла. Обнаружен также эффект структурной чувствительности диссоциации метана, на гранях кристалла Ni диссоциация CH4 следует ряду: Ni(110) > Ni(100) > Ni(111). Как показано импульсным методом, в условиях реакции (3) в зависимости от природы катализатора образуются различные промежуточные соединения CHx: х = 2,7 для Ni/MgO, 2,5 для Ni/SiO2, 2,4 для Ni/Al2O3, 1,9 для Ni/TiO2, 1,0 для Со/SiO2 и 0,75 для Co/Al2O3. Вещества СНх с малыми значениям х легче дают углеродные отложения. По мнению, Н-спилловер на носитель минимизирует углеобразование, сдвигая равновесие в сторону CHx с большими значениями х. Скорость разложения СН4 в условиях реакции (3), по-видимому, выше, чем скорость разложения одного СН4, без участия CO2. Поэтому схема (11) нуждается в соответствующих уточнениях.
С механизмом (21) согласуется ряд экспериментальных данных. Так, величина КИЭ для конверсии смеси CH4 + CO2 на Ni/SiO2 больше, чем в случае образования СО только из метана. Это объясняется двумя маршрутами генерации СО: одна молекула СО образуется из СН4, а другая ─ из СО2 [11]:

Подобный же результат был получен с помощью метода изотопного обмена и ИК-спектроскопии диффузного рассеяния.[16] Диссоциативная адсорбция метана и СО2 на нанесенном родиевом катализаторе была доказана в экспериментах с мечеными молекулами 13СН4 и С18О2. Таким образом, на основании проведенных исследований можно заключить, что реакция (3) протекает по окислительно-восста-новительному механизму (21): СО2 окисляет поверхность катализатора, а СН4 восстанавливает ее.
Большой цикл работ по исследованию механизма углекислотной конверсии метана на Ni/SiO2, Ni/La2O3, Ru/SiO2, Ru/Al2O3 и других катализаторах методами ТАР-реактора (TAP ─ temporary analysis of products), изотопного обмена, рентгеновской фотоэлектронной спектроскопии, ферромагнитного резонанса, электронной микроскопии и ИК-спектроскопии выполнен К. Миродатосом с сотр. [16─17]. Исследование конверсии CH4 на Ni/SiO2 методом изотопного обмена (12СН4 и 13СО2) показало, что после импульса 12СН4 наблюдается быстрое выделение Н2, а на поверхности катализатора, очевидно, остается слой карбида Nix12C, наиболее вероятный его состав Ni2C или Ni3C. Карбидоподобные формы в условиях реакции остаются стационарными и могут гидрироваться обратно в СН4. После импульса 13СО2 регистрируются два импульса СО: сначала образуется 13СО из 13CO2, на поверхности остается Оадс, затем образуется 12СО за счет взаимодействия Оадс с СН4 или с 12Садс после разложения СН4. Решеточный подповерхностный кислород в образовании CO и H2 не участвует. Диоксид CO2 находится в обратимом равновесии с поверхностью и с первой молекулой СО. Образование второй молекулы СО является лимитирующей стадией и лимитирует здесь медленная диффузия атомов С и О. Таким образом, согласно [16─17] и вопреки мнению большинства других исследователей, в углекислотной конверсии метана на Ni/SiO2 лимитирующая стадия не включает диссоциацию С─Н-связи, а небольшое значение КИЭ (kCH4/kCD4) может быть объяснено разрывом С─Н-связи в обратимой стадии диссоциации метана.
В отличие от реакции на Ni/SiO2, для процессов на Ru/SiO2, Ru/Al2O3, Ru/C лимитирующей стадией является диссоциация СН4, а затем СО2 реагирует с адсорбированным углеродом с образованием СО. Накопление углерода здесь минимально и, следовательно, выделение водорода и последующее его окисление подавлено.
Смотрите также
Смачивание, смачивающие агенты, гидрофобизация, гидрофобизирующие агенты
...
Германий (Germanium), Ge
Германий - химический элемент IV группы периодической системы Менделеева; порядковый номер 32, атомная масса 72,59; твёрдое вещество серо-белого цвета с металлическим блеском. Природный Г. представляе ...
Водород (Hydrogenium), Н
Водород - химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,00797. При обычных условиях В. - газ; не имеет цвета, запаха и вкуса.
Историческая ...
