Производство спиртов сернокислотной гидратацией олефинов. Теоретические
сведенияСтатьи / Производство этанола методом гидратации этилена / Производство спиртов сернокислотной гидратацией олефинов. Теоретические
сведения
Реакция присоединения воды была открыта Фарадеем 1825 – 1828 гг. он нашёл, что при действии серной кислоты на этилен, содержащийся в светильном газе, наряду с диэтиловым эфиром и другими продуктами образуется этиловый спирт. Впоследствии было установлено, что первым продуктом присоединения серной кислоты к этилену является этилсерная кислота, которая при гидролизе превращается в этанол. В 1873 году А.М.Бутлеров и В.Горяинов детально изучили сернокислотную гидратацию этилена и предсказали техническое значение этого процесса. В начале тридцатых годов в Советском Союзе М.А.Далиным с сотр. были проведены исследования сернокислотной гидратации олефинов и в 1936 году в Баку была создана первая промышленная установка по получению этилового спирта из нефтяных газов.
Сернокислотная гидратация олефинов является обратимым процессом. Она протекает в две стадии:
CH2=CH2 + Н2SO4 ↔ CH2OSO2OHCH3 + H2O ↔ CH2OHCH3+ Н2SO4
Первая стадия – взаимодействие олефинов с серной кислотой – протекает через образование карбоний-иона, то есть как электрофильное замещение по правилу Марковникова. Поэтому сернокислотная гидратация олефинов выше С2 позволяет получать только вторичные и третичные спирты.
Серная кислота в этом процессе играет роль и катализатора и реагента. Сначала происходит отщепление протона от молекулы кислоты:
Н2SO4 ↔ Н+ + -OSO2OH
Под действием его из молекулы олефина образуется карбоний ион
CH2=CH2 + Н+ → CH2+CH3
который далее реагирует с серной кислотой с отщеплением от неё протона и образованием алкилсульфатов:
CH2+CH3 +Н2SO4 ↔ CH2OSO2OHCH3 + Н+
Если в системе присутствует вода, могут также образовываться ионы алкоксония, которые разлагаются с образов()анием спирта:
CH2+CH3 + H2O ↔ CH2(H2O) +CH3 → C2H5OH + Н+
Наряду с этим протекает ряд побочных реакций:
а)образование диалкил сульфатов:
CH2OSO2OHCH3 + CH2=CH2 → (CH3CH2)2SO4 + Н2SO4
б) образование простых эфиров из двух молекул спирта с отщеплением воды:
2C2H5OH +Н2SO4 ![]() (С2Н5)2О + H2O
(С2Н5)2О + H2O
Причём предполагается, что фактически сначала спирт реагирует с карбоний-ионом, а потом от продукта присоединения отщепляется протон:
C2H5OH + CH2 +CH3 ![]() (С2Н5)2О + H2
(С2Н5)2О + H2
в) образование карбонильных соединений (альдегидов) при дегидрировании спирта:
C2H5OH![]() C2H4O + H2
C2H4O + H2
г) полимеризация олефинов:
nCH2=CH2 ![]() (CH2–CH2)n
(CH2–CH2)n
Из-за этих побочных реакций при гидратации олефинов наряду со спиртами получаются небольшие количества эфиров, альдегидов и полимеров. Кроме того, образование нерасщепляющихся сульфопроизводных приводит к повышенному расходу серной кислоты.
Наиболее низкой реакционной способностью при взаимодействии с серной кислотой обладает этилен. Относительная скорость поглощения разных олефинов 80% серной кислотой меняется следующим образом: этилен (1), пропилен (500), бутилен-1(1 000), изобутилен (16 000).
Видно, что с увеличением молекулярного веса олефинов их реакционная способность возрастает. Олефины изостроения также обладают очень высокой реакционной способностью. Поскольку олефины в зависимости от молекулярного веса и строения реагируют с серной кислотой с разной скоростью, для каждого из них подбирают свои условия: концентрация кислоты, температуру, давление.
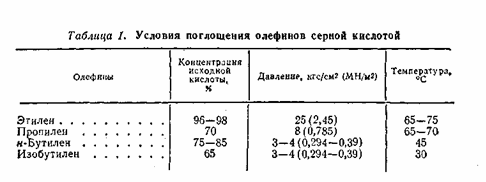
Абсорбцию олефинов серной кислотой осуществляют в реакторах колонного типа с колпачковыми тарелками, на которых расположены змеевики водяного охлаждения, поскольку реакция идёт с выделением тепла. Тепло выделяется не только за счёт собственной реакции, но также за счёт разбавления кислоты водой.
Вторая стадия – гидролиз алкилсульфатов водой, осуществляемый при нагревании острым паром; одновременно происходит отгонка спирта и разбавление серной кислоты до концентрации почти вдвое меньшей, чем исходная. Существенной особенностью процесса является расщепление при гидролизе на спирте кислоту, не только моноалкил-, но и диалкилсульфатов:
CH2OSO2OHCH3 + H2O ↔ C2H5OH + Н2SO4
(CH3CH2)2SO4 + 2H2O ↔ 2C2H5OH + Н2SO4
При избытке олефина количество диалкилсульфата возрастает, а расход кислоты снижается, что очень важно для экономики процесса. Обычно один моль серной кислоты поглощает до 1,2 – 1,3 моль олефина. Другой особенностью является возможность поглощения олефинов из соответствующих фракций (этан – этиленовые, пропан – пропиленовые и др.) без их концентрирования.
Селективность превращения олефина в спирт при сернокислотной гидратации составляет 85 – 95%, а общая степень конверсии олефина превышает 97%.
Смотрите также
Лантаноиды
Лантаноиды (от лантан и греч. еidos - образ, вид), лантаниды, семейство из 14 химических элементов с атомным номером от 58 до 71, расположенных в 6-м периоде системы Менделеева вслед за лантаном (табл ...
