Физико-химические основы процессаСтатьи / Производство аммиака / Физико-химические основы процессаСтраница 1
Синтез аммиака из элементов осуществляется по уравнению:
N2+3H2↔2NH3; ΔH<0
Реакция обратимая, экзотермическая, характеризуется большим отрицательным энтальпийным эффектом (ΔH298 = - 91,96 кДж/моль) и при высоких температурах становится еще более экзотермической (ΔH725 =-112,86 кДж/моль). Согласно принципу Ле Шателье при нагревании равновесие смещается влево, в сторону уменьшения выхода аммиака. Изменение энтропии в данном случае тоже отрицательно (ΔS298=-198,13 кдж/моль К) и не благоприятствует протеканию реакции.
Реакция синтеза аммиака протекает с уменьшением объема. Согласно уравнению реакции 4 моль исходных газообразных компонентов образуют 2 моль газообразного продукта. В условиях равновесия содержание аммиака в смеси будет больше при высоком давлении, чем при низком.
Оценка условий термодинамического равновесия позволяет сделать вывод, что максимального выхода аммиака можно достичь, проводя процесс при высоком давлении и низкой температуре. Однако даже при очень высоких температура (выше 1000°С) процесс синтеза в гомогенной газовой фазе практически не осуществим.
Синтез аммиака протекает с заметной скоростью только в присутствие катализатора, причем катализаторами данной реакции служат твердые вещества. Гетерогенный - каталитический синтез аммиака имеет сложный механизм, который может быть описан следующими стадиями:
· диффузия молекул азота и водорода к поверхности катализатора;
· хемосорбция молекул реагентов на поверхности катализатора;
· поверхностная химическая реакция с образованием неустойчивых промежуточных комплексов и взаимодействия между ними;
· десорбция продукта;
· диффузия продукта реакции (аммиака) в газовую фазу.
Исследование кинетики и механизма реакции позволило сделать вывод о том, что лимитирующей стадией процесса является хемосорбция азота. Тогда механизм синтеза аммиака в сокращенной схеме:
N2+Z ↔ ZN2
ZN2+3H2 ↔ NH3+Z
![]() N2+3H2 ↔ 2NH3
N2+3H2 ↔ 2NH3
где Z - свободный центр поверхности катализатора, ZN2 - хемосорбированная частица.
Скорость обратимой реакции получения аммиака из элементов на большинстве известных катализаторов описывается уравнением Темкина-Пыжева:
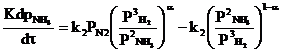 |
где k1 и k2 - константы скоростей образования и разложения аммиака; PN, PH, PNH - парциальные давления азота, водорода, аммиака; α - постоянная,
удовлетворяющая неравенству 0<α<1 и характеризующая степень покрытия поверхности катализатора азотом.
При проведении процесса при атмосферном давлении величина а для промышленных катализаторов в интервале температур 400-500°С равна 0,5.
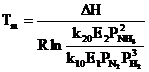 |
Из формулы (2) следует, что с увеличением содержания в циркуляционном газе аммиака и уменьшением содержания азотоводородной смеси оптимальная температура падает.
Из уравнения Темкина-Пыжева видно, что скорость прямой реакции синтеза пропорциональна P1,5, а скорость обратной реакции пропорциональна P0,5. Отсюда очевидно, что с ростом давления наблюдаемая скорость процесса увеличивается.
Смотрите также
Синтез нитробензойной кислоты
Ароматическими карбоновыми кислотами называются
производные бензола, содержащие карбоксильные группы, непосредственно связанные
с углеродными атомами бензольного ядра. Кислоты, содержащие к ...
Контрольный синтез Mg(NO3)2 – MgO – MgCl2
Цель
работы: Изучить цепочку синтеза Mg(NO3)2 - MgO - MgCl2,
и осуществить ее на практике. Рассмотреть физико-химические характеристики
веществ, участвующих в химических реакциях при син ...
