Приближения
молекулярной механики, лежащие в основе квантово-химических методов.Статьи / Применение сингулярной матрицы в химии / Приближения
молекулярной механики, лежащие в основе квантово-химических методов.
В первом – адиабатическом – приближении, предложенном М. Борном и Р. Оппенгеймером в 1927 году, полагают, что движение электронов можно рассматривать как независимое от медленного движения ядер, так как массы ядер значительно (на 3-4 порядка) превышают массу электронов. Решение задачи в этом случае разбивается на два этапа: сначала решают уравнение Шредингера только для электронной части гамильтониана при фиксированном положении ядер. При этом волновая функция должна быть асимметричной по отношению к перестановке электронов, т.е. при перестановке двух электронов с одинаковыми спинами полная волновая функция должна менять знак (принцип Паули). Затем решают задачу о движении (колебании) ядер в поле потенциала, полученного при решении предыдущей задачи, при этом получают значения колебательной энергии молекулы.
Основы квантовой теории многоэлектронных систем были заложены в работах В.Гейзенберга, В. Гайтлера и Ф. Лондона (1926 – 1927 г.г.). Они показали, что существование, устойчивость и свойства этих систем невозможно объяснить в рамках классических представлений. Согласно Гайтлеру и Лондону, связывание между атомами и молекулами в молекуле водорода обусловлено т.н. обменным взаимодействием.
Дальнейшее развитие теории многоэлектронных атомов связано с методом самосогласованного поля, предложенного в 1927 году Д.Р.Хартли. В нем взаимодействие каждого из электронов со всеми остальными заменяется взаимодействием с усредненным полем, создаваемым остальными электронами. В 1930 году В.А.Фок усовершенствовал метод Хартли, использовав для многоэлектронной волновой функции представление в виде слейтеровского детерминанта:
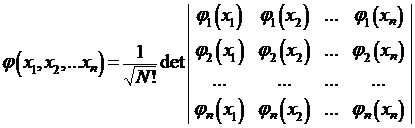 ,
,
где φj(xj) – одноэлектронная спин-орбиталь, xj = (rj, αj), где rj – пространственные координаты, αj – спиновые координаты.
Такой вид волновой функции позволяет учесть принцип Паули. Одноэлектронные функции (орбитали) находят, решая уравнение Хартли-Фока:
Fφi = εiφi,
где F – оператор, называемый фоксианом;
εi – энергии i-той заполненной орбитали.
Система уравнений Хартли-Фока является системой нелинейных интегро-дифференциальных уравнений, которые можно решать методом итераций.
Смотрите также
Литий (Lithium), Li
Литий (лат. Lithium), Li, химический элемент 1 группы периодической системы Менделеева, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Природный Л. состоит из двух стабильных изо ...
Разработка методов синтеза SnF2
Основной путь получения SnF2 – взаимодействие SnO и фтористоводородной кислоты [5] с
последующим выпариванием и сушкой. Специфика технологии олова и его соединений
такова, что первичным продуктом пе ...
Изучение возможности применения магнитных жидкостей для синтеза магнитных сорбентов
Данная
дипломная работа посвящена синтезу и изучению магнитных сорбентов,
представляющих собой магнитный (либо намагниченный) материал с высокими
адсорбционными свойствами.
Преимущество
...
