Теория
ковалентной (гомеополярной) связи. Метод валентных связей.Статьи / Применение сингулярной матрицы в химии / Теория
ковалентной (гомеополярной) связи. Метод валентных связей.Страница 1
Связь называется ковалентной(гомеополярной), если образующие ее атомы обладают близким сродством к электрону.
В этом случае не происходит преимущественной передачи электрона какому-либо атому. Обычно ковалентная связь образуется за счет обобществления электронов, ранее принадлежавших двум отдельным атомам.
Природа ковалентной связи значительно сложнее, чем ионной, и объясняется лишь на основе квантовой механики, причем строго количественное исследование возможно пока что для простейших молекул (Н2, Н2+ и некоторых других). Для сложных соединений решение уравнения Шредингера производится с помощью приближенных методов, дающих чаще всего только качественные результаты.
К наиболее распространенным методам квантовой химии относятся метод валентных связей (электронных пар) и метод молекулярных орбиталей (МО). Конечная цель обоих методов – нахождение энергии и получение из одноэлектронных атомных волновых функций приближенных волновых функций молекул. Значения Е и ψ должны быть такими, чтобы после подстановки уравнение Шредингера превращалось в тождество. Эти методы в ходе математических расчетов широко отражаются на данные физико-химических исследований свойств молекул.
Метод валентных связей (ВС)
разработан Гейтлером и Лондоном (1927) при изучении строения молекулы водорода. Метод основан на предположении, что химическая связь образуется парой электронов в процессе сближения и взаимодействия атомов. Молекулу водорода можно изобразить тремя валентными структурами На – Нb, На- – Нb+ и На+ – Нb- с различным расположением (смещением) электронной пары. Взаимодействие ядер а и b и электронов 1 и 2 схематически изображено на рис 1. Так как волновая функция ψ зависит от координат двух электронов, то уравнение Шредингера для такой молекулярной системы принимает вид:
![]() , (10)
, (10)
где ![]() и
и ![]() - операторы Лапласа по координатам (χ1, y1, z1,) первого электрона и координатам (χ2, y2, z2,) второго электрона.
- операторы Лапласа по координатам (χ1, y1, z1,) первого электрона и координатам (χ2, y2, z2,) второго электрона.
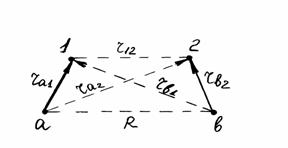
Рис. 1 Схема взаимодействий ядер и электронов в молекуле водорода.
С учетом всевозможных взаимодействий микрочастиц в молекуле Н2 потенциальная энергия находится из равенства:
![]() , (11)
, (11)
где первые два члена в скобках выражают соответственно энергии взаимного отталкивания ядер и электронов, остальные – энергии притяжения электронов к ядрам.
Точное нахождение волновой ψ-функции и минимума полной энергии с помощью уравнений (10) и (11) невозможно даже для такой простой двухэлектронной системы, как молекула Н2, поэтому используется приближенный метод. Сначала оценивают волновую функцию и энергию изолированных атомов, а далее переходят к системе из связанных атомов.
Обозначим волновые функции двух изолированных атомов φа(1) и φb(2). Тогда волновая функция ψІ системы из двух несвязанных атомов выражается произведением ψІ = φа(1) ∙ φb(2).
Допустим, что атомы сблизились на расстояние, достаточное для образования химической связи, и что при этом функция ψІ не изменилась и близка к истинной. Однако в новом состоянии принадлежность каждого электрона к любому из ядер равновероятна, и можно записать, что
ψІІ = φа(2) ∙ φb(1). Тога ψ± - функция молекулы Н2 является линейной комбинацией двух атомных функций:
ψ± = с1ψІ + с2ψІІ, (12)
где с1 и с2 – некоторые постоянные.
Уравнение (12) является общим решением уравнения (10). Конкретное его решение состоит в нахождении значений с1 и с2 и далее по ψ± приближенного значения энергии Е±. Искомую ψ-функцию выбирают с помощью вариационного метода
, которые дает
с1 = ± с2 и ψ± = ψІ + ψІІ.
Функция ψ+ = φа(1)∙φb(2) + φа(2)∙φb(1), не изменяющая знак при перестановке электронов, называется симметричной
. Меняющая знак функция ψ- = φа(1)∙φb(2) – φа(2)∙φb(1), называется асимметричной.
Выражение для энергии, которая отвечает функции ψ±, имеет вид:
![]() , (13)
, (13)
Уравнение (13) показывает, как должно изменяться значение полной энергии для симметричной и асимметричной функции. Величины J, K и S обозначают три интеграла:
Смотрите также
Химические соединения на основе кремния и углерода
Химия - одна из
отраслей естествознания, предметом изучения которой являются химические
элементы (атомы), образуемые ими простые и сложные вещества (молекулы), их
превращения и законы, кото ...
Марганец
Во второй половине ХХ века основную опасность для здоровья населения и проблему для здравоохранения стали представлять неинфекционные заболевания, в первую очередь болезни ЦНС, и сердечно-сосу ...
Америций (Americium), Am
Америций - искусственно полученный радиоактивный химический элемент, относится к актиноидам, атомный номер 95. Стабильных изотопов не имеет. Синтезирован в конце 1944 - начале 1945 американскими учёны ...
