ЭлектролизСтраница 2
Дэви также показал, что зеленоватый газ, который открывший его Шееле (см. гл. 4) считал оксидом, в действительности является элементом. Дэви предложил назвать его хлорин (от греческого χλωρός — желто-зеленый). Позднее Гей-Люссак сократил это название до хлора . Дэви доказал, что соляная кислота, будучи сильной кислотой, не содержит атома кислорода в своей молекуле, и, таким образом, опроверг предположение Лавуазье, который рассматривал кислород как необходимый компонент всех кислот (см. гл. 4.)
Работы Дэви по электролизу продолжил его помощник и ученик Майкл Фарадей (1791—1867) [44], который впоследствии стал знаменитым ученым. Ряд электрохимических терминов, введенных Фарадеем, используется и по сей день (рис. 10). Так, например, он назвал расщепление молекул под действием электрического тока электролизом . По предложению специалиста по античной филологии Уильяма Уэвелла (1794—1866) Фарадей назвал соединение или раствор, способный проводить электрический ток, электролитом ; металлические стержни или пластины, помещенные в расплавленный металл или раствор,— электродами ; электрод, несущий положительный заряд,— анодом ; электрод, несущий отрицательный заряд,— катодом .
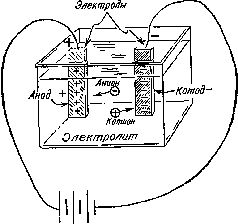
Рис. 10. Электролитический процесс Фарадей объяснял с помощью следующей схемы. Обозначения на рисунке соответствуют предложенной им терминологии.
Реально существующие частицы, благодаря которым электрический ток проходит через раствор или расплав, Фарадей назвал ионами (от греческого ίόν — идущий). Ионы, перемещающиеся по направлению к аноду, он назвал анионами , а ионы, перемещающиеся по направлению к катоду,— катионами .
В 1832 г. Фарадей установил, что электрохимические процессы характеризуются определенными количественными соотношениями, и сформулировал следующие два закона электролиза. Вес вещества, выделившегося на электроде во время электролиза, пропорционален количеству электричества, пропущенного через раствор. Вес металла, выделенного данным количеством электричества, пропорционален эквивалентному весу этого металла.
Таким образом, если при взаимодействии серебра и калия с заданным количеством кислорода серебра в 2.7 раза больше, чем калия, то при данном количестве электричества серебра выделится в 2.7 раза больше, чем калия.
Законы Фарадея, по мнению некоторых химиков, указывали на то, что электричество, как и материю, можно разложить на постоянные минимальные единицы, или, другими словами, на «атомы электричества».
Предположим, что при пропускании электричества через раствор атомы материи притягиваются к катоду или к аноду «атомами электричества», и предположим, что для управления одним «атомом материи» во многих случаях достаточно одного «атома электричества», но иногда требуются два или даже три «атома электричества». Представив себе это, легко объяснить законы электролиза Фарадея.
Однако справедливость этого предположения была подтверждена только в самом конце XIX в., и тогда же было введено понятие «атомы электричества». Сам Фарадей никогда не проявлял энтузиазма по поводу «атомов электричества», да и а
Смотрите также
Эксклюзионная хроматография
...
Состав, структура и синтез ионообменных смол
Иониты, ионообменники, ионообменные сорбенты,
твёрдые, практически нерастворимые вещества или материалы, способные к ионному
обмену. Иониты могут поглощать из растворов электролитов (солей, ...
Калий (Kalium), К
Рассказ об этом элементе можно начать словами известного немецкого химика Юстуса Либиха: "Отдайте почве то, что вы у нее взяли, или не ждите от нее в будущем столько, сколько она давала раньше&qu ...
