Другие методы
получения соединений молибденаСтатьи / Получение молибдена из отходов промышленности / Другие методы
получения соединений молибденаСтраница 1
По одному из вариантов кислотной обработки отвалы, содержащие помимо соединений молибдена до 5% W, обрабатывают 20 – 30%-ной соляной кислотой при нагревании [8, 20]. Молибден в основном переходит в раствор. Кислотой не разлагаются МоО2, MoS2 минералы вольфрама. Кислую пульпу нейтрализуют раствором аммиака до рН 2,5 – 3. Молибден осаждают в составе молибдата железа или полимолибдатов. Осадок отфильтровывают. С раствором отделяются Са, Си, часть Fe. Осадок обжигают, чтобы окислить Мо и МоO2. После обжига его выщелачивают аммиачным раствором. В полученный раствор извлекается до 85% Мо. Соединения вольфрама остаются в остатке от выщелачивания. Аммиачный раствор молибденовых соединений присоединяют к основному раствору от выщелачивания огарков. Общее извлечение молибдена из концентрата достигает 93 – 95%. Потери при обжиге ~ 1,5 %, при выщелачивании (с использованием хвостов) ~2,5%, на прочих операциях до 3%. Переработка отвалов повышает общее извлечение молибдена из концентратов в готовую продукцию.
Из анализа себестоимости парамолибдата с учетом использования хвостов первичного выщелачивания следует, что более 90% себестоимости составляет стоимость сырья.
Для получения молибдена можно использовать также и растворение в азотной кислоте, но этот процесс имеет несколько отличительных черт. Для рентабельности азотнокислотного вскрытия необходимо, чтобы избыток азотной кислоты и продукты ее разложения могли быть регенерированы и эффективно использованы. В противном случае метод нерентабелен, так как вместо прямого использования кислорода воздуха, как это происходит при окислительном обжиге в печах, окисление производится дорогой азотной кислотой, предварительно полученной тоже из азота и кислорода воздуха. Нельзя допускать и выброса в атмосферу окислов азота, получающихся при разложении кислоты в ходе реакции. Схема азотнокислотного метода показана на рис. 4. Основная реакция взаимодействия M0S2 с HNO3:
MoS2 + 6HNO3 = Н2МоО4 + 2H2SO4 + 6N0
Реальный расход кислоты на окисление чистого MoS2 близок к теоретическому по этой реакции. Но при разложении концентрата кислота расходуется еще и на разложение примесных минералов, испарение, термическое разложение. Поэтому общий расход кислоты значительно выше расчетного (расчетный расход 3,16 т, в пересчете на 60%-ную кислоту, на окисление молибденита в 1 т концентрата, содержащего 48 – 50% Мо).
Некоторые возможные реакции взаимодействия примесных минералов с азотной кислотой: .
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2
Са3 (РО4)2 + 6HNO3 = 3Са (NO3)2 + 2Н3РО4
As2S3 + 12HNO3 = 2H3AsO4 + 3H2SO4 + 8NO + 4NO.
Молибденовая кислота первоначально оказывается полностью в растворе, а затем в значительной степени выпадает в осадок. В растворе молибден находится в основном в составе комплексных анионов [MoO(MoO4) (SO4)2]2-. В газовой фазе, помимо NО, находятся другие окислы азота и пары кислот. К концу разложения молибденита азотной кислотой в растворе содержится 15—25 г/л Мо. Растворимость Н2МоО4 в воде ~2 г/л при 20°.
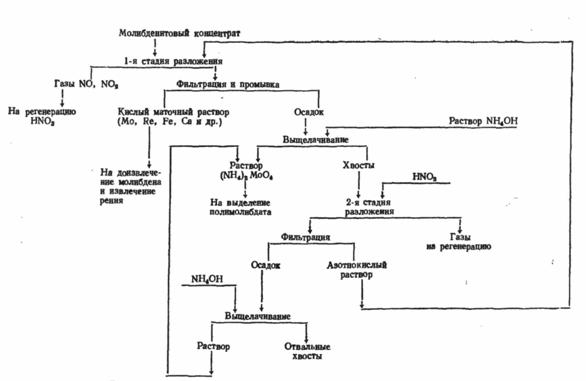
Рис. 4. Получение молибдена с использованием азотной кислоты
Из азотнокислых растворов молибден можно выделить в зависимости от избытка кислоты, содержания молибдена и примесей экстракцией или осаждением ферромолибдата.
Окисление MoS2 гипохлоритом в растворах. Молибденит окисляется гипохлоритом кальция по реакции.
MoS2 + 9СlО- + 6ОН- = МоО![]() + 2SO
+ 2SO![]() + 3Н2О + 9Сl-
+ 3Н2О + 9Сl-
Реакция протекает со значительным выделением свободной энергии: ΔZ298= - 343, 6 ккал. Преимущества процесса гипохлоритного окисления – это избирательность окисления молибдена и полнота извлечения его в раствор при низкой температуре. Практический расход в 1,5 – 2 раза выше теоретического. В заводской практике способ не применяется.
Oкисление молибденита кислородом в автоклавах [20]. Окисление может производиться в растворах КОН, NH4ОН, NaOH, Na2CO3. Принципиальная реакция окисления кислородом проходит по уравнению
2MoS2 + 9O2 +2OH- = 2МоО![]() + 4SO
+ 4SO![]() + 6Н2О
+ 6Н2О
Окисление проходит через промежуточную стадию образования тиосульфата и гидроксокатиона молибдена (VI) [МоО2Н ]+. На степень перехода молибдена в раствор влияют давление, температура, концентрация щелочи. Скорость реакции зависит от концентрации ионов ОН-, поэтому она возрастает в ряду растворов аммиака→соды→щелочи. Ионы меди действуют на окисление каталитически: при концентрации меди 100 мг/л скорость его в два раза выше, чем в отсутствие меди. Добавка меди позволяет снизить давление, температуру и время обработки.
Смотрите также
Получение и применение кальция и его соединений
...
Совершенствование технологии получения технического ПАН жгутика
Полиакрилонитрильные
волокна и нити в настоящее время представляют наиболее распространенный вид
промышленно освоенных карбоцепных синтетических волокон. Это связано со
специфически ценными ...
Сурьма (Stibium), Sb
Сурьма - химический элемент V группы периодической системы Менделеева; атомный номер 51, атомная масса 121,75; металл серебристо-белого цвета с синеватым оттенком. В природе известны два стабильных из ...
