Расчет материального баланса процесса хлорирования этиленаСтатьи / Получение дихлорэтана из этилена / Расчет материального баланса процесса хлорирования этиленаСтраница 1
Данные для расчета:
На основании табл. 4.1 [1] определяем выходы продуктов реакции при температуре 255 К:
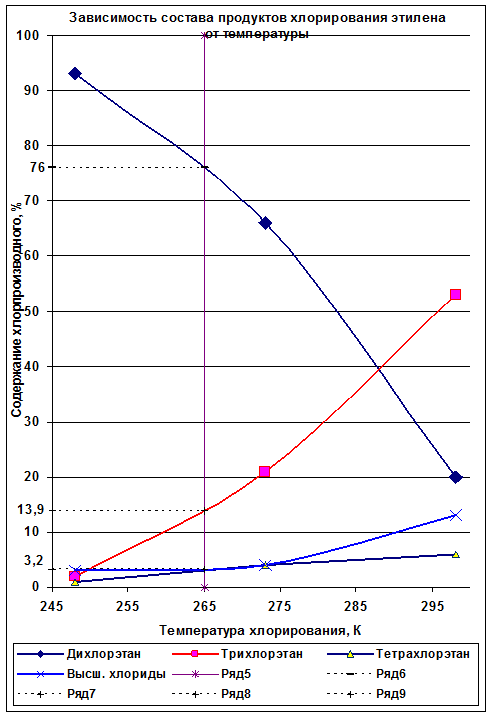
Рис. 2. Выход продуктов реакции.
На основании рис. 2 данные по выходу продуктов реакции сводим в табл. 1.
Таблица 1.
Выход продуктов реакции при Т=265К
|
Состав продуктов хлорирования, %(масс.) | |
|
Дихлорэтан |
76,0 |
|
Трихлорэтан |
13,9 |
|
Тетрахлорэтан |
3,2 |
|
Высшие хлориды |
3,2 |
Избыток этилена в % от стехиометрии 10
В дихлорэтане растворяется 50 % хлористого водорода
Давление в системе, МПа 0,89
Производительность установки, т/год дихлорэтана 10000.
Число рабочих дней в году 350
Таблица 2.
Состав хлора и этиленовой фракции
|
Состав хлора, %(об.) |
Состав этиленовой фракции, %(об.) | |||||
|
Cl2 |
CO2 |
H2 |
N2 |
C2H4 |
C2H6 |
C3H6 |
|
98 |
1,2 |
0,3 |
0,5 |
92,0 |
6,0 |
2,0 |
Часовая производительность установки по дихлорэтану составляет:
![]() .
.
При этом образуется:
Трихлорэтана ![]() ;
;
Тетрахлорэтана ![]() ;
;
Высших хлоридов ![]() ;
;
При взаимодействии хлора с этиленом протекают следующие реакции:
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
Исходя из этих реакций, определяем:
1. Расход этилена на образование ди-, три-, тетрахлорэтана и высших хлоридов:
![]()
или
![]() .
.
С учетом 10 %-ного избытка этилена его расход составит:
1,1·318,1=349,9 м3/ч
или
349,9·1,250=437,4кг/ч.
2. Расход этиленовой фракции (с учетом 10 %-ного избытка этилена):
![]() .
.
3. Расход хлора:
![]()
или
![]() .
.
4. Расход технического хлора:
![]() .
.
5. Количество образующегося хлористого водорода:
![]()
или
![]() .
.
6. Количество отходящих газов:
|
Газы |
Объем, м3/ч |
Состав %(об.) |
Количество, кг/ч |
|
Этилен |
380,3·0,92-318,1=31,8 |
30,77 |
(31,8:22,4)·28=39,8 |
|
Этан |
380,3·0,06=22,8 |
22,08 |
(22,8:22,4)·30=30,6 |
|
Пропилен |
380,3·0,02=7,6 |
7,36 |
(7,6:22,4)·42=14,3 |
|
Двуокись углерода |
392,5·0,012=4,7 |
4,56 |
(4,7:22,4)·44=9,3 |
|
Азот |
392,5∙0,005=2,0 |
1,91 |
(2,0:22,4)·28=2,5 |
|
Водород |
392,5∙0,003=1,2 |
1,14 |
(1,2:22,4)·2=0,1 |
|
Хлористый водород |
66,5·0,5=33,3 |
32,18 |
(33,3:22,4)·36,5=54,2 |
|
ИТОГО: |
103,3 |
100,00 |
150,6 |
Смотрите также
Переработка жидкого топлива
К жидким химическим топливам относятся нефть и продукты ее
переработки (нефтепродукты), а также продукты гидрирования твердого топлива. В
настоящее время практическое значение имеют только н ...
Серебро (Argentum), Ag
Серебро - химический элемент I группы периодической системы Менделеева, атомный номер 47, атомная масса 107,868; металл белого цвета, пластичный, хорошо полируется. В природе находится в виде смеси дв ...
