Электрохимические производстваПериодическая система / Методика решения задач по теоретическим основам химической технологии / Электрохимические производства
Электролизом называется окислительно-восстановительная реакция, протекающая при пропускании постоянного электрического тока через расплав или раствор электролита.
Сущность электролиза заключается в следующем: при пропускании электрического тока через расплав или раствор электролита положительные ионы электролита (ионы металлов или водорода) притягиваются катодом, а отрицательные ионы (кислотные остатки или гидроксильные группы) — анодом. Приносимые к катоду от источника тока электроны присоединяются к положительным ионам электролита, восстанавливая их. Одновременно отрицательные ионы электролита отдают свои электроны аноду, от которого они двигаются к источнику тока. Теряя свои электроны, они окисляются в нейтральные атомы или группы атомов. Таким образом, у катода протекает процесс восстановления, а у анода — процесс окисления.
А (+): nAn- - ne- → nAp-
K (-): nBn+ + ne- → nBp+
Оба процесса образуют единую окислительно-восстановительную реакцию. Но в отличие от обычных окислительно-восстановительных реакций электроны от восстановителя к окислителю переходят не прямо, а посредством электрического тока. Катод, приносящий электроны, является восстановителем, а анод, уносящий их,— окислителем.
Основными показателями электрохимических производств являются выход по току, степень использования энергии. Расходный коэффициент по энергии, напряжение, приложенное к электролизеру, и др. Большинство вычислений основано на законе Фарадея, согласно которому масса вещества, выделившегося при электролизе пропорционально силе тока I
, времени электролиза t
и электрохимическому эквиваленту этого вещества ЭЭ
Масса вещества вычисляется по формуле
![]() (1.3.1)
(1.3.1)
где, I -
сила тока, F
– постоянная Фарадея (96500 Кл)
![]() (г-экв) (1.3.2)
(г-экв) (1.3.2)
Mr
– относительная молекулярная масса вещества,
n
– заряд иона (абсолютное значение) в виде которого вещество находится в растворе или в расплаве (т.е. количество отданных или принятых электронов).
Выход по току определяется отношением массы вещества, выделившегося при электролизе, к массе вещества, которое теоретически должно выделится согласно закону Фарадея, и выражается в процентах:
![]() (1.3.3)
(1.3.3)
Масса mтеор находится по формуле
![]()
![]() (1.3.4)
(1.3.4)
Выход по энергии определяется по уравнению
![]() (1.3.5)
(1.3.5)
где, Етеор и Епр – теоретическое и практическое напряжение разложения при электролизе соответственно, В; η - выход по энергии,%.
Выход по энергии может быть вычислен и по количеству затраченной энергии:
![]() (1.3.6)
(1.3.6)
где wтеор и wпр – количество энергии, теоретически необходимое и практически затраченное на получение единицы продукта.
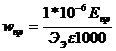 (1.3.7)
(1.3.7)
где 1000 – коэффициент перевода Вт*ч в кВт*ч;
1*10-6 – число, используемое для перевода граммов в тонны.
Теоретический расход электроэнергии находится по отношению
![]() (1.3.8)
(1.3.8)
где φразл – напряжение разложения.
Смотрите также
Рубидий (Rubidium), Rb
Большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в вид ...
Калифорний (Californium), Cf
Получен искусственно в 1950 группой Сиборга в Калифорнийском университете в Беркли.
Назван в честь Калифорнийского университета в Беркли, где и был получен. Как писали авторы, этим названием они хотел ...
Селен (Selenium), Se
Селен - химический элемент VI группы периодической системы Менделеева; атомный номер 34, атомная масса 78, 96; преимущественно неметалл. Природный С. представляет собой смесь шести устойчивых изотопов ...
