Гидрофобные взаимодействияПериодическая система / Межмолекулярные взаимодействия / Гидрофобные взаимодействияСтраница 1
Итак, нужно найти силы, ответственные за мицеллообразование. Как уже отмечалось, взаимодействие меду молекулами воды довольно сильное вследствие образования водородных связей. Введение неполярных молекул в воду оказывает сильное воздействие на сетку водородных связей, что приводит к уменьшению энергии взаимодействия. Энергетический проигрыш может быть минимизирован, если молекулы воды каким-то образом организуются вокруг молекулы растворенного вещества. Ценою этому будет проигрыш в энтропии. И свободная энергия переноса неполярной молекулы в воду при комнатной температуре будет определяться большим вкладом энтропии. При растворении неполярных молекул они будут стремиться минимизировать воздействие на сетку водородных связей за счет самоагрегирования. Рис. иллюстрирует силы притяжения между двумя атомами неона в воде. Притяжение возникает как результат эффектов сольватации. Сближение атомов неона вызывается растворителем. Притяжение между двумя атомами неона в газовой фазе характеризуется намного менее глубоким минимумом. На рис. показано, что замена одного из атомов неона на бесконечную гидрофобную стенку, как и следовало ожидать, приводит к еще большему притяжению в воде. Таким образом, можно сделать вывод о том, что гидрофобные взаимодействия обусловливают мицеллообразование.
Из табл. видно, что чем длиннее углеводородная часть молекул ПАВ, тем легче они агрегируют, о чем свидетельствуют более низкие значения ККМ. Гидрофобные взаимодействия могут быть достаточно сильными и являются результатом тонкого баланса энергетического и энтропийного вкладов. В настоящее время принято также считать, что гидрофобные взаимодействия являются главной движущей силой фолдинга молекул белков. Можно привести разные аргументы в пользу того или другого объяснения гидрофобных взаимодействий. Один из способов - допустить сильное когезионное взаимодействие между молекулами воды. Более того, эти взаимодействия чувствительны к ориентации, и любая попытка разрушить структуру приводит к изменению свободной энергии. В каком виде проявляется этот фактор - в энтропийной форме или энергетическом вкладе - это уже вторично. В случае неполярных молекул, например углеводородов, проигрыш в свободной энергии не может быть восполнен взаимодействием с молекулами растворенного вещества.
Простой способ оценки энергии переноса молекулы углеводорода из неполярного окружения в воду задается уравнением
![]()
где R - радиус молекулы растворенного вещества. Подобное выражение можно использовать для оценки гидрофобного взаимодействия между двумя контактирующими молекулами неполярных растворенных веществ:
![]()
где r - радиус молекулы воды.
Критическая концентрация мицеллообразования алкилсульфатов с различной длиной алкильной цепи.
Снижение KKM происходит вследствие гидрофобных взаимодействий между алкильными цепями
|
ПАВ |
ККМ, мМ |
|
C8SO4" |
160 |
|
CioSO4 |
40 |
|
Ci2SO4" |
10 |
|
Ci4SO4 |
2.5 |
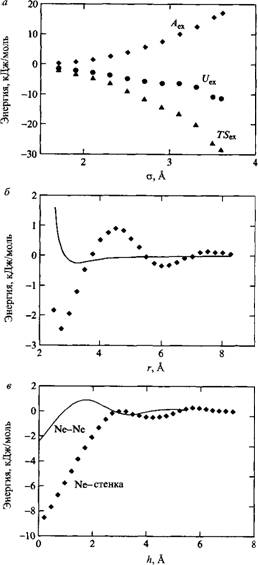
Моделирование гидрофобного эффекта методом Монте-Карло: а - свободная энергия гидратации для леннард-джонсовской частицы в воде. Параметр е принят постоянным и равным 0.62 кДж/моль; параметр у - варьируемая величина. Энтропийный и энергетический вклады показаны отдельно. б - Свободная энергия взаимодействия между двумя атомами неона в воде. Сплошная линия - то же для взаимодействия двух атомов неона в газовой фазе, в - Свободная энергия взаимодействия атома неона с гидрофобной стенкой в воде. Сплошная линия - взаимодействие двух атомов неона в воде. С разрешения American Institute of Physics
Смотрите также
Теория Бутлерова
...
Электрохимические методы анализа и их современное аппаратурное оформление: обзор WEB–сайтов фирм–продавцов химико-аналитического оборудования
Электрохимические методы анализа
(электроанализ), в основе которых лежат электрохимические процессы, занимают
достойное место среди методов контроля состояния окружающей среды, так как
спос ...
Натрий (Natrium), Na
Натрий - химический элемент I группы периодической системы Менделеева; атомный номер 11, атомная масса 22,9898; серебристо-белый мягкий металл, на воздухе быстро окисляющийся с поверхности. Природный ...
