МалахитМатериалы / МалахитСтраница 9
![]() (CuSO4*5Н2О) =5,5/249=0,024 моль
(CuSO4*5Н2О) =5,5/249=0,024 моль
По уравнению (*) найдем количество малахита:
![]() (малахита) =0,011 моль
(малахита) =0,011 моль
mтеор (малахита) =0,011 * 222=2,442 г
Рассчитаем практический выход продукта:
mпракт (малахита)пр=2,21 г
![]()
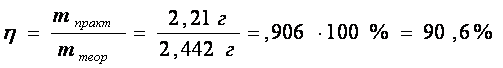
В результате мною было получено 2,21г малахита. Практический выход составил 90,6%
Проведем качественные реакции на обнаружение иона меди Cu2+ . Для этого насыпем малахит в три пробирки:
В первую пробирку добавим избыток раствора карбоната натрия, наблюдаем появление красивой синей окраски раствора:
Cu2(OH)2CO3 + Na2CO3 = Na2[Cu(CO3)2] + Cu(OH)2↓.
Во вторую прильем уксусную кислоту:
(CuOН)2CO3+ 4CH3СООН = 2Cu(CH3COO)2+ CO2↑ + ЗH2O.
К третьей добавим аммиак, который окрашивает при этом раствор в красивый темно-синий цвет:
Cu2(OH)2CO3 + 8NH3 = [Cu(NH3)4]CO3 + [Cu(NH3)4](OH)2.
К четвертой пробирке прильем концентрированный раствор HCl. Окраска станет ярко-зеленой:
Сu2(ОН)2СО3 + 2HCl = 2CuCl2 + CO2↑ + H2O.
Пятую пробирку нагреем над пламенем горелки. Наблюдаем выделение газа и образование черного осадка:
Сu2(ОН)2СО3=2CuO↓ + CO2↑+ H2O.
2. 2. Вывод.
При выполнении практической части я сократила количество используемых веществ в 2 раза по сравнению с методикой получения, так как в лаборатории находится малое количество данных реагентов. В результате опыта мной было получено 2,21г порошкообразного малахита. Практически выход продукта составил 90,6% от теоретического, что удовлетворяет поставленной цели. Потери вещества произошли во время промывания а также при высушивании на фильтровальной бумаге.
III. Список литературы.
1. Малахит. БСЭ, т. 15, с. 276;
2. " Ферсман А.Е. "Рассказы о самоцветах" Л., Детгиз, 1952.
3. Марченков В.И. Ювелирное дело. М.: Высшая школа, 1975, с. 37; М., 1982;
4. Здорик Т.Б., Фельдман Л.Г. Минералы и горные породы, т. 1. М, «ABF», 1998 г.;
5. Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. М., Химия, 1994.;
6. Г.Смит. Драгоценные камни. М., «Мир», 1980;
7. http://www.velund.ru/2008/04/15/malakhit.html физ свва
8. http://him.1september.ru/articlef.php?ID=200300705
9. Карякин Ю.В., Ангелов И.И. «Чистые химические вещества», Издательство «Химия», Москва, 1974 г.;
10. Реми Г. «Курс неорганической химии» том 1. Издательство «Химия», Москва 1967 г.;
11. Подчайнова В.Н., Медь, М., Свердловск: Металургиздат, 1991. – 249с.;
Смотрите также
Азот (Nitrogenium), N
Азот - химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса.
Историческая справка. Соединения А. - селитра, ...
Лигнин
В
технологии переработки древесной зелени под хвойной древесной зеленью понимают
– хвойную лапку, то есть охвоенные побеги, таким образом, хвойная древесная
зелень представляет собой смесь ...
