МалахитМатериалы / МалахитСтраница 6
Следовательно, запись (CuOH)2CO3 – основная соль, дигидроксикарбонат меди(II) – наиболее полно отражает состав малахита.
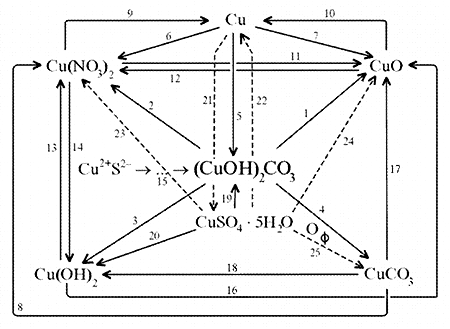
Рассмотрим реакцию разложения малахита:
https://kovka116.ru отзывы о ковка казань.(CuOH)2CO3 →2CuO +H2O + CO2
В зависимости от этапа изучения химии она может быть описана:
а)
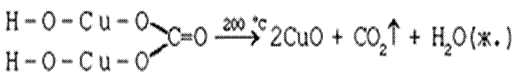
б) на ионно-структурном уровне:
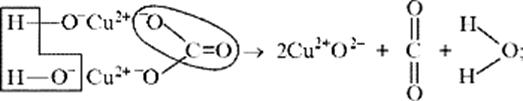
в) на электронно-ионном уровне:
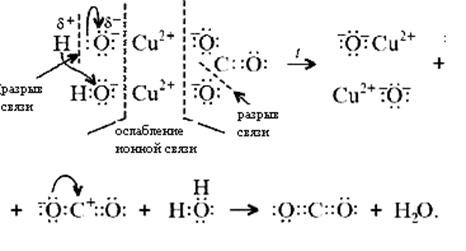
Знание свойств карбонатов и нерастворимых в воде оснований позволяет утверждать, что малахит будет растворяться в кислотах:
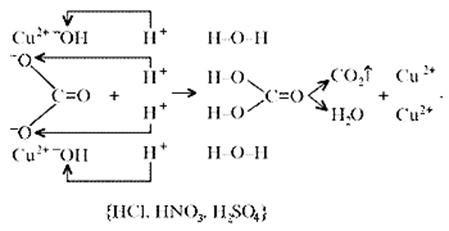
Примечание. Ион Н+ присоединяется к кислороду в составе гидроксид- и карбонат-ионов по донорно-акцепторному механизму:
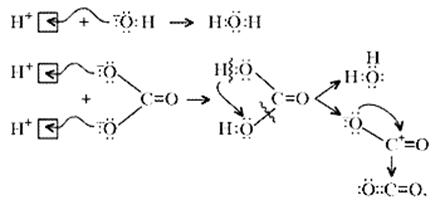
Малахит можно рассматривать как производное гидроксида меди(II), в котором часть гидроксильных ионов замещена на карбонат-ионы (таково, собственно, определение понятия «основная соль»). Кроме реакции с кислотами при определенных условиях он может реагировать с кислотными оксидами. Мысль совершенно невероятная, учитывая нерастворимость малахита в воде – главнейшее условие взаимодействия кислотных оксидов с основаниями, точнее со щелочами. Однако имеет место реакция:
(CuOH)2CO3 + CO2 = CuCO3)2 + Н2О
«Химические события» соответствуют такому механизму:
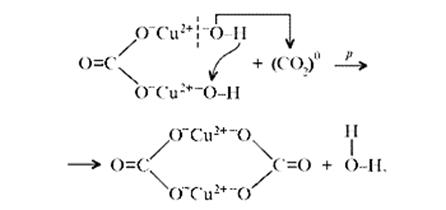
Обратим внимание на образование средней соли. Теперь считается доказанным, что карбонат меди(II) можно помещать в список солей угольной кислоты.[11] Малахит, как известно, не растворяется в воде, но может подвергаться гидролизу (из-за гидролиза, собственно, невозможно получить осадок среднего карбоната меди):
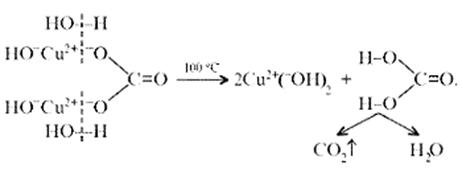
Из-за способности ионов меди образовывать комплексные ионы малахит растворяется, в частности, в карбонатах щелочных металлов:
(CuOH)2CO3 + K2CO3 = K2[Cu(CO3)2] + Cu(OH)2.
темно-синий
Теоретическим обоснованием этому может служить запись:
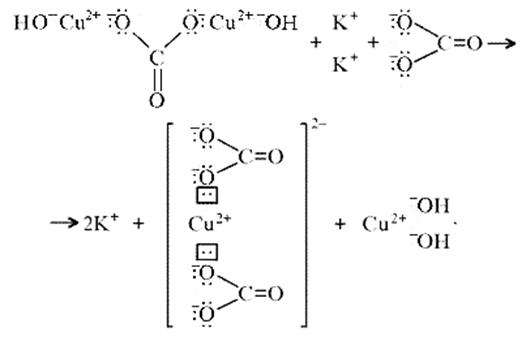
Схема генетических связей: образование и свойства малахита.
|
|
1. Разложение малахита. 2. Растворение малахита в кислотах. 3. Гидролиз малахита. 4. Реакция с углекислым газом. 5. Коррозия меди на воздухе (образование зеленого налета на медных предметах во влажном воздухе):
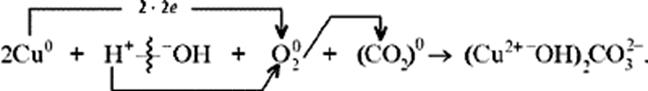
6. Растворение меди в азотной кислоте. 7. Прокаливание меди на воздухе. 8. Взаимодействие твердого тела карбоната меди(II) c крепким раствором азотной кислоты. 9. Восстановление меди из ее соли более активным металлом или в результате электролиза. 10. Восстановление меди из ее оксида водородом или другим удобным восстановителем (монооксид углерода, древесный уголь). 11. Нагревание твердого тела нитрата меди(II) до полного разложения. 12. Растворение оксида CuO в концентрированной азотной кислоте. 13. Нейтрализация основания Cu(OH)2 азотной кислотой. 14. Взаимодействие нитрата меди(II) с раствором щелочи. 15. Образование малахита в природных условиях. В самых общих чертах генезис сложных геохимических процессов можно представить так:
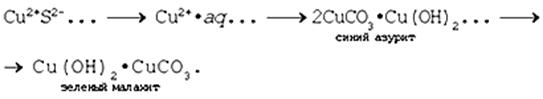
16. Нагревание твердого вещества Cu(ОН)2 (несильно, чтобы не перевести оксид CuO в оксид Cu2O) до полного разложения. 17. Нагревание CuCO3 до полного разложения на CuO и СО2. 18. Гидролиз карбоната меди(II). 19. Получение порошкообразного малахита в лабораторных условиях. Формально химизм образования дисперсного малахита можно выразить следующими уравнениями:
Смотрите также
Литий (Lithium), Li
Литий (лат. Lithium), Li, химический элемент 1 группы периодической системы Менделеева, атомный номер 3, атомная масса 6,941, относится к щелочным металлам. Природный Л. состоит из двух стабильных изо ...
Физии обнаружили два ранее неизвестных свойства золота
Физики из Института технологий американского штата Джорджия сообщили об обнаружении двух ранее неизвестных свойств золота, которые драгоценный металл проявляет на микроскопическом уровне. В масштабе & ...
Проектирование вертикального аппарата с приводом и мешалкой
...