Химический синтез оксида магния (MgO) из нитрата магния Mg(NO3)2
Mg(NO3)2 → MgO. Физико – химическая
характеристика Mg(NO3)2 :Периодическая система / Контрольный синтез Mg(NO3)2 – MgO – MgCl2 / Химический синтез оксида магния (MgO) из нитрата магния Mg(NO3)2
Mg(NO3)2 → MgO. Физико – химическая
характеристика Mg(NO3)2 :
1. Встречается в природе в небольших количествах в виде нитромагнезита (гидрат), или магнезиевой селитры.
2. Нитрат магния при обычных условиях кристаллогидрат состава Mg(NO3)2·
nH2O, где n- 2, 6, 9, n зависит от способа выделения нитрата магния и температурного режима.
3. Соединение Mg(NO3)2 ·
2H2O представляет собой бесцветные кристаллы с плотностью 2,025 г/см3, плавятся при 129,5 °С, растворимы в воде, спирте и концентрированной азотной кислоте.
4. Mg(NO3)2 ·
6H2O – бесцветные призматические кристаллы моноклинной формы с плотностью 1,464 г/см3; они плавятся при температуре 95°С, кипят при 143°С, также растворимы в воде, спирте и концентрированной азотной кислоте.
5. Mg(NO3)2 ·
9H2O бесцветные кристаллы с плотностью 1,356 г/см3 плавятся при 74°С, плотность 1,302 г/см3
6. Растворимость безводной соли в воде (на 100 г) при 20°С 73,3 г (42,3 %), при повышении температуры растворимость повышается и при 80°С она составляет 110,1 г (52,4 %).
7. Выделен также неустойчивый кристаллогидрат состава Mg(NO3)2 ·4H2O плавящийся при температуре 52 °С.
8. Легко теряет кристаллизационную воду по следующей схеме:
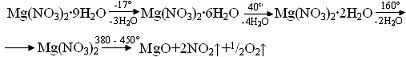
При температуре выше 380° разлагается.
9. При неполном разложении кристаллогидратов получаются продукты различного состава 2Mg(NO3)2· MgO, Mg(NO3)2· Mg(OН)2, Mg(NO3)2·3Mg(OН)2·8H2O, Mg(NO3)2·2Mg(OН)2·4H2O и т. д.
10. Растворяется в безводном жидком аммиаке и абсолютизированном спирте, образуя аддукты различного состава:
Mg(NO3)2 + nNH3 = Mg(NO3)2 ·
nNH3 (n=1, 2, 4, 6)
Mg(NO3)2 + 6CH3OH = Mg(NO3)2 ·
6CH3OH
Mg(NO3)2 + 6C2H5OH = Mg(NO3)2 ·
6C2H5OH.
11. Водный раствор Mg(NO3)2 имеет кислую среду раствора вследствие гидролиза по катиону: Mg(NO3)2 + H2O ↔MgOHNO3 + 2HNO3
Mg2+ + H2O ↔ MgOH+ + H+ (гидролиз по первой ступени)
MgOHNO3 + H2O ↔ Mg(OH)2↓+ HNO3
MgOH+ + H2O ↔ Mg(OH)2↓+ H+ (гидролиз по второй ступени)
12. При взаимодействии с растворами щелочей выпадает белый осадок гидроксида магния Mg(OH)2.
Mg(NO3)2 +2NaOH = Mg(OH)2↓+ 2Na NO3.
13. Не растворяется в растворах плавиковой, фосфорной, угольной, кремниевой кислот, химически взаимодействует с ними с образованием нерастворимых в воде солей:
Mg(NO3)2 + 2HF = MgF2↓+ 2HNO3;
3Mg(NO3)2 + 2H3PO4 = Mg3(PO4)2↓+ 6HNO3;
Mg(NO3)2 + CO2 + H2O = MgCO3↓+2HNO3;
Mg(NO3)2 + H2SiO3 = MgSiO3↓+2HNO3
Сильно (все выпавшие осадки белого цвета). разбавленная
Смотрите также
Химия поверхностно-активных веществ
...
Использование отходов сельскохозяйственного производства
Наличие большого количества
отходов химической промышленности, сельскохозяйственного производства,
различных видов бытовых отходов может быть неплохой альтернативой традиционным
наполнителя ...
