Кислородные
соединения кремнияМатериалы / Химические соединения на основе кремния и углерода / Кислородные
соединения кремния
Важнейшим кислородным соединением кремния является диоксид кремния SiO2 (кремнезем), имеющий несколько кристаллических модификаций.
Низкотемпературная модификация (до 1143 К) называется кварцем. Кварц обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидностями кремнезема являются халцедон, опал, агат,. яшма, песок. [5, 322]
Кремнезем химически стоек; на него действуют лишь фтор, плавиковая кислота и растворы щелочей. Он легко переходит в стеклообразное состояние (кварцевое стекло). Кварцевое стекло хрупко, химически и термически весьма стойко. Отвечающая SiO2 кремниевая кислота не имеет определенного состава. Обычно кремниевую кислоту записывают в виде xH2O-ySiO2. Выделены кремниевые кислоты: H2SiO3 (H2O-SiO2) - метакремниевая (три-оксокремниевая), H4Si04 (2H20-Si02) - ортокремниевая (тетра-оксокремниевая), H2Si2O5 (H2O * SiO2) - диметакремниевая.
Кремниевые кислоты - плохо растворимые вещества. В соответствии с менее металлоидным характером кремния по сравнению с углеродом H2SiO3 как электролит слабее Н2СОз. [4,467 - 468]
Отвечающие кремниевым кислотам соли-силикаты-в воде нерастворимы (кроме силикатов щелочных металлов). Растворимые силикаты гидролизуются по уравнению
2SiOз2-+H20=Si2O52-+20H-.
Концентрированные растворы растворимых силикатов называют жидким стеклом. Обычное оконное стекло-силикат натрия и кальция-имеет состав Na20-CaO-6Si02. Его получают по реакции
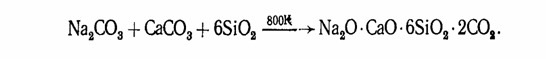
Известно большое разнообразие силикатов (точнее, оксосиликатов). В строении оксосиликатов наблюдается определенная закономерность: все состоят из тетраэдров Si04, которые через атом кислорода соединены друг с другом. Наиболее распространенными сочетаниями тетраэдров являются (Si2O76-), (Si3O9) 6-, (Si40l2) 8-, (Si6O1812-), которые как структурные единицы могут объединяться в цепочки, ленты, сетки и каркасы (рис 4).
Важнейшими природными силикатами являются, например, тальк (3MgO * H20-4Si02) и асбест (SmgO*H2O*SiO2). Как и для SiO2, для силикатов характерно стеклообразное (аморфное) состояние. При управляемой кристаллизации стекла можно получить мелкокристаллическое состояние (ситаллы). Ситаллы характеризуются повышенной прочностью.
Кроме силикатов в природе широко распространены алюмосиликаты. Алюмосиликаты - каркасные оксосиликаты, в которых часть атомов кремния заменена на трехвалентный Аl; например Na12 [ (Si, Al) 04] 12.
Для кремниевой кислоты характерно коллоидное состояние при воздействии на ее соли кислот H2SiO3 выпадает не сразу. Коллоидные растворы кремниевой кислоты (золи) при определенных условиях (например, при нагревании) можно перевести в прозрачную, однородную студнеобразную массу-гель кремниевой кислоты. Гели - высокомолекулярные соединения с пространственной, весьма рыхлой структурой, образованной молекулами Si02, пустоты которой заполнены молекулами H2O. При обезвоживании гелей кремниевой кислоты получают силикагель - пористый продукт, обладающий высокой адсорбционной способностью.
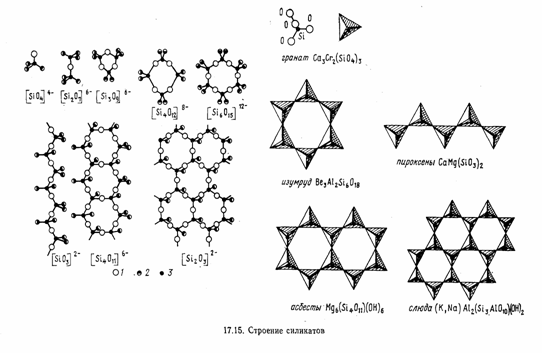
Рисунок 4. Строение силикатов.
Смотрите также
Тантал (Tantalum), Та
Тантал - химический элемент V группы периодической системы Менделеева; атомный номер 73, атомная масса 180,948; металл серого цвета со слегка свинцовым оттенком. В природе находится в виде двух изотоп ...
Применение химических веществ группы углеводов в росписи тканей
...
Использование энергосберегающих технологий для кристаллизации сульфата натрия
...
