Сложный характер изотерм связывания ПАВ белкамиМатериалы / Смеси поверхностно-активных веществ и белков / Сложный характер изотерм связывания ПАВ белками
Ассоциация ПАВ с белками напрямую доказывается изотермами связывания, которые можно измерить методом равновесного диализа или другими подходящими методами. Однако такие данные получены для ограниченного числа белков. Изотермы связывания характеризуются комбинацией слабого некооперативного связывания в области низких концентраций ПАВ и интенсивного кооперативного связывания при более высоких концентрациях ПАВ. Часто связывание ПАВ описывают так: сначала связывание малых количеств с высоким сродством к специфическим центрам связывания белка, а затем стадия кооперативного связывания. В ряде случаев ход изотермы связывания ПАВ белком аналогичен изотермам связывания ПАВ гиброфобизированным полимером, например как при взаимодействии додецилсульфата натрия с лизоцимом. При низких концентрациях наблюдается участок некооперативного связывания, за которым следует первая антикооперативная область, а затем протяженная область кооперативного связывания. При описании изотерм связывания для противоположно заряженных белка и ПАВ следует отметить явление осаждения. Было показано, что так называемое связывание с высоким сродством при низких концентрациях ПАВ включает осаждение стехиометрического комплекса. Белки, как и неионные полимеры, сильнее, взаимодействуют с анионными ПАВ, чем с катионными ПАВ. В то же время обнаружить ассоциацию белков с НПАВ часто не удается. Анионные ПАВ могут также образовывать ассоциаты с белками при рН выше их изоэлектрической точки, когда белок заряжен отрицательно.
Структуры и механизм образования комплексов ПАВ-белок почти не описаны. По-видимому, на первой стадии комплекс возникает за счет гидрофобных взаимодействий между гидрофобными «хвостами» ПАВ и неполярными остатками или доменами белка. Вторая стадия аналогична мицеллообразованию, индуцированному полимером. На этой стадии связывания происходит разворачивание молекулы белка, что делает доступным для взаимодействия с ПАВ гидрофобные группы белка, находящиеся внутри нативной глобулы. Таким образом, многие глобулярные белки постепенно переходят в состояние неупорядоченных клубков. В этом случае для описания комплекса белка с ПАВ используют модель структуры «жемчужного ожерелья», принятую для синтетических полимеров: гирлянда небольших глобулярных мицелл, декорирующая полипептидную цепь. По-видимому, образующиеся мицеллы имеют значительно меньшие числа агрегации, чем мицеллы индивидуального ПАВ или в присутствии гидрофильных полимеров.
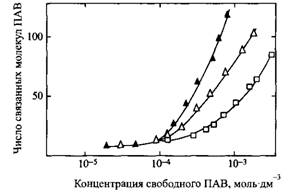
Рис. 4. Изотерма связывания бычьим сывороточным альбумином додецилсульфата натрия и октилбензолсульфоната натрия. Связывание выражено числом молекул ПАВ на молекулу белка. Белые символы отвечают 10-2 M NaCl, черные —KT1 M NaCl
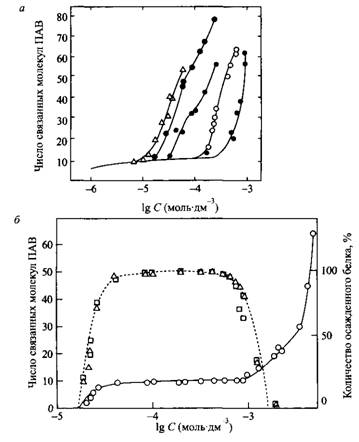
Рис. 5. а — Изотермы связывания додецилсульфата натрия бычьим сывороточным альбумином при различных рН: 3.8, 4.1, 4.8, 5.6 и 6.8 б — Изотерма связывания додецилсульфата натрия лизоцимом и осаждение белка из смешанного раствора в зависимости от концентрации додецилсульфата натрия
Смотрите также
Введение
Свою дипломную работу хочу
начать со слов ученого-земляка М.В. Ломоносова, которые являются эпиграфом
данной работы:
“Вольность и союз наук необходимо
требуют взаимного сообщения и беззавистного ...
Исследование твердых электролитов
...
Учёные создали золотой алюминий и синее серебро
Физики из института оптики Университета Рочестера поменяли стандартный серебристый цвет алюминия на золотой, потом на голубой, а затем на серый. Впоследствии оказалось, что не только этот металл спосо ...
