Односторонние реакции 1— порядкаМатериалы / Скорость образования, расходования компонента и скорость реакции / Односторонние реакции 1— порядка
Это реакции вида:
А → Продукты.
Выражение для скорости реакции имеет вид:
W = K1C. (10)
Она связана со скоростью расходования исходного вещества А соотношением:
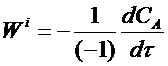
где (- 1) - стехиометрический коэффициент исходного вещества А. Подставляя это выражение в уравнение (10) и опуская для простоты индекс А, получим:
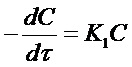 (11)
(11)
Из этого равенства нужно найти в явном виде зависимость концентрации вещества А от времени.
Разделим переменные в уравнении (11):
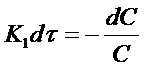
Проинтегрируем полученное уравнение при изменении времени в пределах от 0 до τ и концентрации от 0 до С
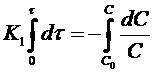
и получим
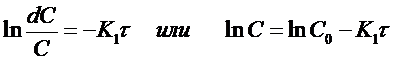 (12)
(12)
Полученная формула позволяет вычислить концентрацию исходного вещества A в любой момент времени протекания реакции при известной концентрации С0 и константе скорости К1, если провести её потенцирование:
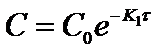
где С0 - начальная концентрация исходного вещества А в момент времени τ=0;
С - концентрация этого вещества к моменту времени г,
К1 - константа скорости реакции 1ого порядка. Она имеет размерность - 1/время (с, мин, ч). Индекс 1 означает порядок реакции.
Из уравнения (12) можно получить выражение для вычисления константы скорости реакции 1го порядка:
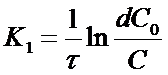 , 1/время.
, 1/время.
Уравнение (12) можно представить несколько в ином виде. Обозначим х - уменьшение концентрации исходного вещества к моменту времени τ, тогда
![]() .
.
Уравнение для константы скорости реакции первого порядка примет вид:
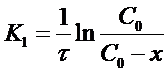 (13)
(13)
Из уравнения (13) при известной константе скорости и начальной концентрации вещества Со можно определить х в момент времени τ. Для этого преобразуем уравнение (13) к виду:
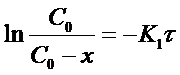
После потенцирования этого выражения получим
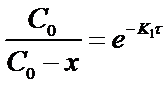
Разрешив уравнение относительно х найдем формулу для его вычисления:
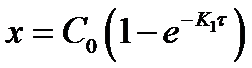
Основной задачей химической кинетики является расчет скоростей химических реакций. Их определяют из уравнения (7) по известной константе скорости. К1 находят экспериментально. При этом по экспериментальным данным изменения концентрации исходного вещества от времени строят график в координатах 1пС - τ. В этой системе координат кинетическое уравнение реакции 1го порядка (12) представляет прямую линию. Тангенс угла наклона этой линии равен К1 (см. рисунок 2).
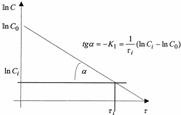
Рисунок 2 - Графическое определение константы скорости реакции 1го порядка
Иногда для характеристики скорости реакции пользуются временем полупревращения или полураспада τ1/2.
τ1/2 - это промежуток времени, в течение которого реагирует
половина взятого вещества: С = 1/2С0; С0 = 2С,
тогда
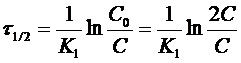
Или
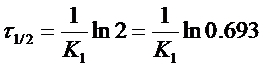
Из уравнения следует, что τ1/2 для реакции первого порядка не зависит от начальной концентрации исходного вещества и определяется только константой скорости.
Уравнения кинетики реакции 1 ого порядка характеризуют не только скорости мономолекулярных реакций, но применимы и к сложным реакциям. Многие сложные реакции протекают как реакции первого порядка.
Смотрите также
ТАЙНОЕ ИСКУССТВО ГЕРМЕСА
Всем истинным искателям Света. Пусть то, что найдут они здесь, наставит и укрепит
их в поиске Квинтэссенции, Камня Философов, подлинной Мудрости и совершенного Счастья,
Summum Bonum.
Д-р Израэль ...
Кремний (Silicium), Si
Третьим элементом, наиболее распространенным в природе, является кремний. Название этого элемента произошло от латинского "ляпис креманс", что значит - камень, дающий огонь. Так назывался тв ...
Методика
проведенных экспериментов
Изучение процесса комплексообразования проводилось методом
рН-метрического титрования. Оно проводилось при помощи иономера с точностью
измерения ±0,05 ед. рН со стеклянным и хлорсеребряным электрода ...
