Зависимость скорости реакции от концентрации исходных веществ.
Закон действующих масс.Материалы / Скорость образования, расходования компонента и скорость реакции / Зависимость скорости реакции от концентрации исходных веществ.
Закон действующих масс.
Рассмотрим элементарную бимолекулярную реакцию проходящую в закрытой системе:
А + В -> Продукты.
Для того, чтобы реакция шла молекулы А и В должны сблизиться на достаточно близкое расстояние (столкнуться) и прореагировать.
Доля прореагировавших молекул А и В пропорциональна вероятности их активных столкновений. Эта вероятность, как вероятность сложного события, пропорциональна произведению вероятностей того, что молекулы А и В одновременно окажутся в данной точке реакционного пространства (например, реакционного сосуда). Названые вероятности пропорциональны концентрациям молекул А и В. Следовательно, вероятность одновременного присутствия частиц А и В в одной и той же точке пространства (элементарном объёме) пропорциональна произведению их концентраций.
Из этих рассуждений следует, что скорость элементарной бимолекулярной реакции пропорциональна произведению концентраций веществ А и В, то есть можно записать:
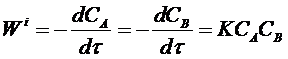
(7)
где 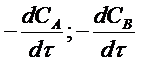 -
-
скорости расходования исходных веществ, которые отрицательны;
К - коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости химической реакции
- это скорость реакции при концентрации исходных веществ равной единице. Иногда эту величину называют удельной скоростью.
Если элементарная бимолекулярная реакция протекает между двумя одинаковыми молекулами, например
2А → Продукты,
то вместо уравнения (7) получим:
W = KCACA=KCA2 (8)
Из уравнений (7) и (8) видно, что скорость элементарных бимолекулярных реакций пропорциональна произведению концентраций реагентов (исходных веществ) в степени равной их стехиометрическим коэффициентам в уравнении реакции. Такая зависимость носит название - закон действующих масс
, установленный норвежскими учеными Гульдбергом и Вааге (1864 - 1867 г.).
Для любой элементарной реакции
а1А1 + а2А2 + а3А3 → Продукты
уравнение скорости реакции (закон действующих масс) будет иметь вид:
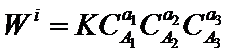
Показатели степени а1 а2 аз - называют порядками реакции по веществам А1 А2, А3.
Сумма 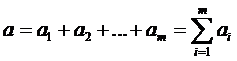
(9)
- называется общим или суммарным порядком реакции.
Следовательно, порядок реакции равен сумме показателей степеней в уравнении зависимости скорости реакции от концентрации исходных веществ.
Для элементарной реакции он равен сумме (положительных значений) стехиометрических коэффициентов исходных веществ в уравнении реакции (или стадии реакции).
Порядок элементарных реакций не бывает больше трех. Связано это с тем, что порядок реакции отражает в какой-то мере количество частиц участвующих в элементарном акте реакции. Вероятность одновременной встречи четырех частиц практически равна нулю. Поэтому
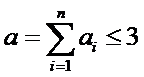
Зависимость скорости реакции от концентрации реагирующих веществ называется кинетическим уравнением. Для элементарных реакций может быть только шесть типов кинетических уравнений в соответствии с числом видов химических уравнений.
Для сложных химических реакций, состоящих из нескольких элементарных стадий, может быть степенная зависимость скорости реакции от концентрации с показателями степени отличными от стехиометрических:
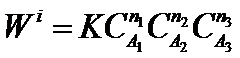
где п1 п2 п3 - порядки реакции по веществам А1 А2 А3. Общий порядок реакции равен:
п
= п1+ п2+ п3 .
При этом значения п1 п2 п3 могу быть не равны стехиометрическим коэффициентам, иметь дробные величины и больше трех.
Смотрите также
Прогнозирование критического давления. Основные методы прогнозирования
...
Электрохимические методы анализа и их современное аппаратурное оформление: обзор WEB–сайтов фирм–продавцов химико-аналитического оборудования
Электрохимические методы анализа
(электроанализ), в основе которых лежат электрохимические процессы, занимают
достойное место среди методов контроля состояния окружающей среды, так как
спос ...
Нептуний (Neptunium), Np
Нептуний был впервые получен Э.М. Макмилланом и Ф.Х. Абельсоном в 1940 году.
Назван в честь планеты Нептун.
В природе содержится в качестве примеси в урановых рудах.
Нептуний получают восстановлением ...
