Скорость образования, расходования компонента и скорость реакцииМатериалы / Скорость образования, расходования компонента и скорость реакции / Скорость образования, расходования компонента и скорость реакцииСтраница 1
Для практических целей важно знать скорость химических реакций. От скорости протекания реакции зависят количество вещества, получаемого в единицу времени, размеры аппарата для производства нужного продукта.
В кинетике химических реакций различают скорости образования и расходования компонентов и скорость реакции
Скоростью образования (расходования) количества данного i-того вещества (компонента) во время химической реакции или скоростью реакции Wi по данному i-тому веществу называется изменение количества этого вещества ni (в молях) в единицу времени т в единице реакционного пространства R:
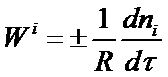
Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем V (R = V) и изменение количества вещества рассматривают в единице объема.
Если реакция гетерогенная и протекает на границе раздела фаз, то реакционным пространством является поверхность S (R = S) и изменение количества вещества относят к единице поверхности.
При этом скорость расходования исходных веществ будет отрицательной (со знаком - ), так как с течением времени количество исходных веществ уменьшается.
Скорость образования продуктов реакции величина положительная (со знаком + ), так как с течением времени количество их увеличивается.
На практике наибольшее значение имеют изотермические реакции (протекающие при Т = const), происходящие в замкнутых (закрытых) или открытых системах.
Замкнутая система не обменивается веществом с окружающей средой, но энергией (теплотой, работой) она может обмениваться. Такой системе в химической технологии соответствует прерывный процесс, например, в закрытых чанах или автоклавах.
В открытой системе происходит обмен с окружающей средой не только энергией, но и веществом. Открытой системе в химической технологии соответствует непрерывный процесс в потоке. Рассмотрим скорость образования (расходования) i-того вещества в замкнутой гомогенной системе
(R = V):
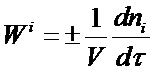 (1)
(1)
Если во время реакции V = const, то его можно внести под знак дифференциала. Так как отношение ni /V = Ci то вместо уравнения (1) получим:
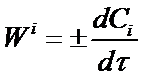 (2)
(2)
где Сi - концентрация рассматриваемого i-того вещества в данный момент времени.
Если химическая реакция формально простая и может быть записана одним уравнением, то скорости расходования исходных веществ и образования продуктов реакции зависят от стехиометрических коэффициентов перед ними, например, для реакции:
А + В = 2АВ. (3)
с учетом этого можно получить соотношение:
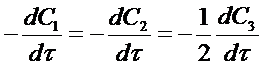
или формально
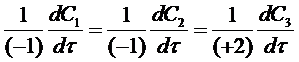
где C1 и С2 - концентрации исходных веществ А и В;
С3 - концентрация продукта реакции АВ
-1,2 - стехиометрические коэффициенты перед веществами реакции с учетом правила знаков (для исходных веществ стехиометрические коэффициенты принимаются отрицательными). С учетом уравнения (2) соотношение (4) примет вид:
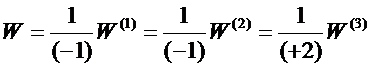 (5)
(5)
где W - скорость реакции, одинаковая для всех веществ, участвующих в данной реакции;
![]() - скорости расходования исходных веществ и образования продукта реакции. В общем виде выражение (5) запишется формулой:
- скорости расходования исходных веществ и образования продукта реакции. В общем виде выражение (5) запишется формулой:
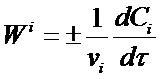 (6)
(6)
где vi - стехиометрические коэффициенты в уравнении реакции.
Таким образом, скорость реакции равна скорости расходования (образования) данного вещества реакции, деленной на его стехиометрический коэффициент с учетом принятых знаков. Она всегда положительна.
Скорость расходования исходных веществ отрицательна, а образования продуктов реакции положительна.
При изучении кинетики химических реакций обычно получают зависимость концентрации какого-либо компонента от времени τ.
Ci=f(τ).
Графическое представление изменения концентрации компонента реакции с течением времени в координатах Сi - и называют кинетической кривой. Кинетические кривые для исходных веществ и продуктов имеют вид (рисунок 1):
Смотрите также
Применение химических веществ группы углеводов в росписи тканей
...
Прогнозирование критических свойств веществ и критериев подобия
...
Кремний (Silicium), Si
Третьим элементом, наиболее распространенным в природе, является кремний. Название этого элемента произошло от латинского "ляпис креманс", что значит - камень, дающий огонь. Так назывался тв ...
