2. Уравнение изотермы химической реакцииКниги / Физическая химия / ЛЕКЦИЯ № 5. Химическое равновесие / 2. Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ΔG = 0.
Если реакция протекает необратимо, то ΔG ≤ 0 и можно рассчитать изменение ΔG.
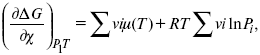
где χ – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
Если
д χ = 1,
то
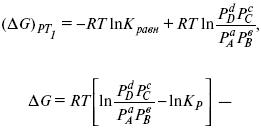
это уравнение изотермы химической реакции
.
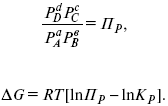
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
1) Пp< Кp, ΔG < 0, слева направо;
2) Пp> Кp, ΔG > 0, справа налево;
3) Пp= Кp, ΔG = 0, химическое равновесие.
Смотрите также
Таллий (Thallium), Tl
Знаменитый Крукс, был большим специалистом по спектроскопии. Прекрасно понимая, что спектроскоп - мощный инструмент отыскания новых элементов, Крукс исследовал с его помощью огромное количество различ ...
Иттрий (Yttrium), Y
Минерал иттербит, который дал имя иттрию, назван в честь деревни Иттербю (Ytterby) расположенной на острове Руслаген в Швеции. В дальнейшем, минерал иттербит изменил свое название на гадолинит в честь ...
