Влияние температуры на положение равновесияМатериалы / Коллоидная химия / Влияние температуры на положение равновесия
Повышение либо понижение температуры означает приобретение либо потерю системой энергии и, следовательно, должно изменять величину константы равновесия.
Запишем уравнение (I.99) в следующем виде:
![]() (I.104)
(I.104)
![]() (I.105)
(I.105)
Продифференцировав выражение (I.105) по температуре, получаем для зависимости константы равновесия от температуры уравнение (I.106) – изобару Вант-Гоффа:
![]() (I.06)
(I.06)
Рассуждая аналогичным образом, для процесса, проходящего в изохорных условиях, можно получить изохору Вант-Гоффа:
![]() (I.107)
(I.107)
Изобара и изохора Вант-Гоффа связывают изменение константы химического равновесия с тепловым эффектом реакции в изобарных и изохорных условиях соответственно. Очевидно, что чем больше по абсолютной величине тепловой эффект химической реакции, тем сильнее влияет температура на величину константы равновесия. Если реакция не сопровождается тепловым эффектом, то константа равновесия не зависит от температуры.
Экзотермические реакции
: ΔH° < 0 (ΔU° < 0). В этом случае, согласно (I.106, I.107), температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево.
Эндотермические реакции
: ΔH° > 0 (ΔU° > 0). В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо).
Графики зависимостей константы равновесия от температуры для экзотермических и эндотермических реакций приведены на рис. I.4.
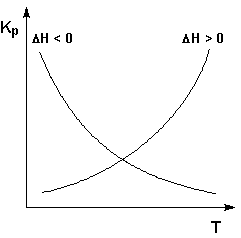
Рис. 1.4
Зависимость константы равновесия от температуры.
Действие рассмотренных нами факторов (давления, концентрации и температуры), равно как и любых других, на систему, находящуюся в состоянии равновесия, обобщает принцип смещения равновесия, называемый также принципом Ле Шателье – Брауна:
Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный процесс, компенсирующий данное воздействие.
Принцип Ле Шателье – Брауна является одним из следствий второго начала термодинамики и применим к любым макроскопическим системам, находящимся в состоянии истинного равновесия.
Смотрите также
Японские ученые объяснили принцип работы биологических наномоторов
Коллектив японских и американских ученых создал несложную действующую модель, позволяющую лучше понять принцип работы биологических наномоторов, сообщают исследователи в препринте своей статьи (ведущи ...
Стандартизация измерения рН в неводных средах. Методы определения рН стандартных буферных растворов
Данная курсовая
работа содержит 3 раздела, 35 страниц и 2 таблицы.
Целью работы
является изучение кислотности неводных растворов, методы ее определения и
стандартизация измерения, а такж ...
Теория образования оксидов азота при горении
Условия образования оксидов при
горении до сих пор не разработаны в достаточной мере и требуют глубокой
проработки весьма сложной химической кинетики процесса в сочетании с детальным
изучен ...
