Классификация химических реакцийМатериалы / Классификация химических реакций / Классификация химических реакцийСтраница 1
В процессе изучения химии приходится встречаться с классификациями химических реакций по различным признакам (табл.1).
Таблица 1 - Классификация химических реакций
|
По тепловому эффекту |
Экзотермические – протекают с выделением энергии 4Р + 5О2 = 2Р2О5 + Q; CH4 + 2О2 → СО2 + 2H2O + Q |
|
Эндотермические – протекают с поглощением энергии Cu(OH)2 | |
|
По числу и составу исходных и образовавшихся веществ |
Реакции разложения – из одного сложного вещества образуется несколько более простых: СаСО3 |
|
Реакции соединения – из нескольких простых или сложных веществ образуется одно сложное: 2H2 + О2 → 2H2O C2H4 + H2 → C2H6 | |
|
Реакции замещения – атомы простого вещества замещают атомы одного из элементов в сложном веществе: Zn + 2HCl = ZnCl2 + H2↑ CH4 + Cl2 → CH3Cl + HCl | |
|
Реакции обмена – два сложных вещества обмениваются составными частями: AgNO3 + HCl = AgCl↓ + HNO3 HCOOH + CH3OH → HCOOCH3 + H2O | |
|
По агрегатному состоянию реагирующих веществ |
Гетерогенные – исходные вещества и продукты реакции находятся в разных агрегатных состояниях: Fe(т) + CuCl2(р-р) → Cu(т) + FeCl2(р-р) 2Na(т) + 2C2H5OH(ж) → 2C2H5ONa(р-р) + H2(г) ↑ |
|
Гомогенные – исходные вещества и продукты реакции находятся в одном агрегатном состоянии: H2(г) + Cl2(г) = 2HCl(г) C2H5OH(ж) + CH3COOH(ж) → CH3COOC2H5(ж) + H2O(ж) | |
|
По наличию катализатора |
Каталитические 2H2O2 |
|
Некаталитические S + О2 | |
|
По направлению |
Необратимые – протекают в данных условиях только в одном направлении: H2SO4 + BaCl2 → BaSO4+ 2HCl CH4 + 2О2 → СО2 + 2H2O |
|
Обратимые – протекают в данных условиях одновременно в двух противоположных направлениях: 3H2 + N2 ↔ 2NH3 ; C2H4 + H2 ↔ C2H6 | |
|
По изменению степени окисления атомов элементов |
Окислительно-восстановительные – реакции, идущие с изменением степени окисления: Fe0 + 2H+1Cl-1 → Fe2+Cl2-1 + H20 H+1C0O-2 H+1 + H2 → C-2 H3+1 O-2 H+1 |
|
Неокислительно-восстановительные – реакции, идущие без изменения степени окисления: S+4O4-2 + H2O → H2+ S+4O4-2 CH3NH2 + HCl → (CH3NH3)Cl |
Как видим, существует различные способы классификации химических реакций, из которых более подробно мы рассмотрим следующие.
По признакуизменения числа исходных и конечных веществ.
Здесь можно найти 4 типа химических реакций (рис.6): реакции соединения
, реакции разложения
, реакции обмена
, реакции замещения
.
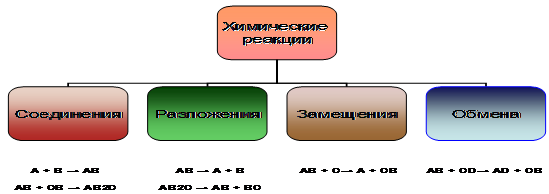
Рисунок 6 – Классификация химических реакций по признаку изменения числа исходных и конечных веществ
Приведем примеры таких реакций. Для этого воспользуемся уравнением получения гашеной извести и уравнению получения негашеной извести
СаО + Н2О = Са(ОН)2
Са(ОН)2 = СаО + Н2О
Эти реакции относятся к разным типам химических реакций.
Первая реакция является типичной реакцией соединения
, поскольку при ее протекании две молекулы реагентов СаО и Н2О соединяются в одну, более сложную молекулу Са(ОН)2.
Вторая реакция Са(ОН)2 = СаО + Н2О является типичной реакцией разложения
: здесь реагент Ca(OH)2 разлагается с образованием двух других, более простых веществ (продуктов реакции).
Смотрите также
Осмий (Osmium), Os
Попробуйте подсчитать, какой путь совершает кончик пера автоматической ручки при движении по бумаге только в пределах одной тетради в 12 листов. Пусть это будет зависеть от величины букв, манеры письм ...
Методы определения содержания свинца, цинка, серебра в питьевой воде
Настоящий стандарт распространяется на питьевую
воду и устанавливает методы определения содержания свинца, цинка и серебра.
Пробы воды отбирают по ГОСТ 2874—82 и ГОСТ
24481—80
Объем пр ...
