Аналитические реакции катионов магния Mg 2+Материалы / Качественный анализ (кислотно-основная классификация) / Аналитические реакции катионов магния Mg 2+
1. Реакция с щелочами и аммиаком: Mg2+ + 2 ОН- —> Mg(OH)2 (белый аморфный)
Mg2+ + 2 NHrH2O = Mg(OH)2 + 2 NH4+
Осадок не растворяется в щелочах, растворяется в НС1, H2SO4, CH3COOH: Mg(OH)2 + 2 Н+ -► Mg2+ + 2 Н2О
2. Реакция с гидрофосфатом натрия Na2HPO4 (фармакопейная).
Реакцию проводят в аммиачном буфере:
Mg2+ + НРО42- + NH3 -- NH4MgPO4 | (белый кристаллический) При проведении реакции в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок MgHPO4. Избыток NH4 мешает выпадению NH4MgPO4. Осадок NH4MgPO4 растворяется в минеральных кислотах и в уксусной кислоте:
NH4MgPO4 + 3 НС1 - Н3РО4 + MgCl2 + NH4C1
NH4MgPO4+ 2 CHjCOOH = NH4H2PO4 + (CH3COO)2Mg
Проведению реакции мешают катионы Li+, Ca2+, Sr2, Ba2+ и др.
3. Реакция с магнезоном I - п - нитробензолазорезорцином.
В щелочной среде магнезон I, имеющий красную окраску, образует с катионами М^2+,комплекс синего цвета, сорбирующийся на осадке Mg(OH)2:
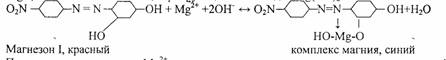
При малых концентрациях Mg2+ осадок не выделяется, а раствор окрашивается в синий цвет. Проведению реакции мешают Cd2+, Sn2+, Cr3+, Fe2+, Co2+, Ni2+.
4.Реакция с 8- оксихинолином.
Реакцию проводят в аммиачной среде при рН = 8—13 (при нагревании).
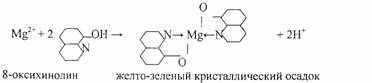
Осадок растворим в минеральных кислотах и в уксусной кислоте. Проведению реакции мешают катионы, также образующие комплексы с 8 -оксихинолином (Cu2+, Zn2+. Cd2+, Fe3+ и др.).
5. Реакция с хинализарином.
Реакцию проводят в щелочной среде. Образуется синий осадок комплексного соединения – хинализарината магния состава MgL(OH), где НL – условное обозначение молекулы хинализарина:
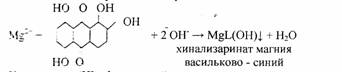
При небольшом содержании катионов Mg2+в растворе осадок не выпадает, а раствор окрашивается в цвет. Проведению реакций мешают катионы алюминия.
6. Реакция с растворимыми карбонатами (Nа2С03).
2 Mg2++ 2 Nа2С03 + Н2О = (МgОН)2С0з (белый аморфный) +4 Nа + СО2. Осадок (МgОН)2С0з,растворим в кислотах и в солях аммония.
7. Реакция с оксалатом аммония (NH4)С2О4.
Mg2++ (NH4)С2О4 = Mg С2О4 (белый) + 2 NH4
8. Катионы Mg2+ с дифенилкарбазидом (С6Н5 NHNH)2С0 образуют комплекс красно— фиолетового цвета.
Смотрите также
Скорость химической реакции
Вокруг нас постоянно происходят тысячи химических реакций. Горит
костер и горит газ в конфорке газовой плиты, ржавеет железо, молоко
превращается в творог, на фотопленке возникают изображени ...
