Уникальные свойства аммиака и его соединенийСтатьи / Уникальные свойства аммиака и его соединенийСтраница 1
По значимости в неорганической химической индустрии и неорганической химии аммиак - самое важное водородное соединение азота. При обычных условиях аммиак - бесцветный газ с резким запахом и едким вкусом. Он токсичен: раздражает слизистые оболочки, а острое отравление вызывает поражение глаз и воспаление легких. При охлаждении до -33,35˚С аммиак сжижается, превращаясь в бесцветную жидкость, а при -77,7˚С затвердевает (при н.у.).
По своей химической природе он представляет собой нитрид водорода H3N. В химическом строении аммиака sp3-гибридные орбитали атома азота образуют три связи с тремя атомами водорода, которые занимают три вершины чуть искаженного тетраэдра. Электроны связей Н-N довольно сильно смещены от водорода к азоту (азот более электроотрицателен, чем водород), поэтому молекула аммиака в целом характеризуется значительной полярностью.
Четвертая вершина тетраэдра занята неподеленной электронной парой азота, что дополнительно увеличивает полярность молекулы аммиака и обеспечивает химическую ненасыщенность и реакционноспособность его молекул.
В аммиаке между молекулами действуют водородные связи, вследствие чего аммиак обладает рядом экстремальных свойств по сравнению с другими водородными соединениями элементов пятой группы главной подгруппы. Вследствие полярности молекул и достаточно высокой диэлектрической проницаемости жидкий аммиак является хорошим неводным растворителем. В жидком аммиаке хорошо растворяются щелочные и щелочно-земельные металлы, сера, фосфор, йод, многие соли и кислоты. Вещества с функциональными полярными группами в жидком аммиаке подвергаются электролитической диссоциации.
По растворимости в воде аммиак превосходит любой другой газ: при 0˚С 1 объем воды поглощает 1200 объемов газообразного аммиака. Прекрасная растворимость аммиака в воде обусловлена возникновением межмолекулярных водородных связей.
Интересным свойством молекул аммиака является их способность к структурной инверсии, т.е. к "выворачиванию наизнанку" путём прохождения атома азота сквозь образованную атомами водорода плоскость основания пирамиды. Потенциальный барьер этой инверсии равен 25 кДж/моль, осуществлять её могут лишь молекулы, достаточно богатые энергией. Скорость инверсии сравнительно невелика - она в 1000 раз меньше скорости ориентации молекул NH3 электрическим полем. С такой инверсией связано электромагнитное излучение строго определённой частоты в радиодиапазоне СВЧ. На молекулах NH3 советские физики в 1955 году создали новый вид генератора излучения – так называемый мазер.
Аммиачный мазер позволил создать аппаратуру для очень точного измерения времени. Благодаря таким сверхточным «молекулярным часам» установлено, что продолжительность земных суток ежегодно возрастает в - среднем на 0,00043 секунд.
Химические свойства. Аммиак весьма реакционноспособное соединение. Благодаря неподелённой электронной паре у атома N для NH3 особенно характерны и легко осуществимы реакции присоединения. Партнёрами аммиака в таких реакциях могут быть молекулы и ионы, способные предоставить для электронной пары азота место на своих незаполненных электронных оболочках. Типичный пример — образование иона аммония путём присоединения иона водорода Н+ к молекуле NH3
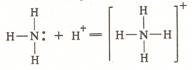
Или в другой записи:
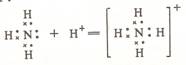
В ионе аммония все связи ковалентны и неразличимы (равноценны). Такой механизм образования химической ковалентной связи называют донорно-акцепторным, а связь — координационной. Атом азота, имеющий свободную электронную пару,— донор; ион водорода Н+, предоставляющий место этой паре на свободной электронной оболочке,— акцептор. Со многими солями аммиак образует продукты присоединения — аммиакаты (например, CuSO4*5NH3, CuSO4*4NH3*H2O). Они подобны гидратам.
По поводу растворения А. в воде существовало мнение, что это — химическое взаимодействие по схеме:
