Аллотропные модификации углеродаСтатьи / Углерод и его основные неорганические соединения / Аллотропные модификации углеродаСтраница 1
Элементарный углерод образует три аллотропные модификации: алмаз, графит, карбин.
1. Алмаз – бесцветное, прозрачное кристаллическое вещество, чрезвычайно сильно преломляющее лучи света. Атомы углерода в алмазе находятся в состоянии sр3-гибридизации. В возбуждённом состоянии происходит распаривание валентных электронов в атомах углерода и образование четырёх неспаренных электронов. При образовании химических связей электронные облака приобретают одинаковую вытянутую форму и располагаются в пространстве так, что их оси оказываются направленными к вершинам тетраэдра. При перекрывании вершин этих облаков с облаками других атомов углерода возникают ковалентные связи под углом 109°28', и образуется атомная кристаллическая решетка, характерная для алмаза.
Каждый атом углерода в алмазе окружён четырьмя другими, расположенными от него в направлениях от центра тетраэдров к вершинам. Расстояние между атомами в тетраэдрах равно 0,154 нм. Прочность всех связей одинакова. Таким образом, атомы в алмазе «упакованы» очень плотно. При 20°С плотность алмаза составляет 3,515 г/см3. Этим объясняется его исключительная твердость. Алмаз плохо проводит электрический ток.
В 1961 г. в Советском Союзе было начато промышленное производство синтетических алмазов из графита.
При промышленном синтезе алмазов используются давления в тысячи МПа и температуры от 1500 до 3000°С. Процесс ведут в присутствии катализаторов, которыми могут служить некоторые металлы, например Ni. Основная масса образующихся алмазов – небольшие кристаллы и алмазная пыль.
Алмаз при нагревании без доступа воздуха выше 1000°С превращается в графит. При 1750°С превращение алмаза в графит происходит быстро.
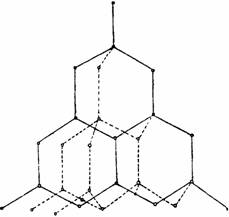
Структура алмаза
2. Графит – серо-чёрное кристаллическое вещество с металлическим блеском, жирное на ощупь, по твердости уступающее даже бумаге.
Атомы углерода в кристаллах графита находятся в состоянии sр2-гибридизации: каждый из них образует три ковалентные σ-связи с соседними атомами. Углы между направлениями связей равны 120°. В результате образуется сетка, составленная из правильных шестиугольников. Расстояние между соседними ядрами атомов углерода внутри слоя составляет 0,142 нм. Четвёртый электрон внешнего слоя каждого атома углерода в графите занимает р-орбиталь, не участвующую в гибридизации.
Негибридные электронные облака атомов углерода ориентированы перпендикулярно плоскости слоя, и перекрываясь друг с другом, образуют делокализованные σ-связи. Соседние слои в кристалле графита находятся друг от друга на расстоянии 0,335 нм и слабо связаны между собой, в основном силами Ван-дер-Ваальса. Поэтому графит имеет низкую механическую прочность и легко расщепляется на чешуйки, которые сами по себе очень прочны. Связь между слоями атомов углерода в графите частично имеет металлический характер. Этим объясняется тот факт, что графит хорошо проводит электрический ток, но все, же не так хорошо, как металлы.
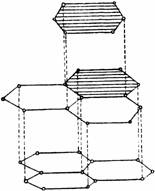
Структура графита
Физические свойства в графите сильно различаются по направлениям – перпендикулярному и параллельному слоям атомов углерода.
При нагревании без доступа воздуха графит не претерпевает никаких изменений до 3700°С. При указанной температуре он возгоняется, не плавясь.
Искусственный графит получают из лучших сортов каменного угля при 3000°С в электрических печах без доступа воздуха.
Графит термодинамически устойчив в широком интервале температур и давлений, поэтому он принимается в качестве стандартного состояния углерода. Плотность графита составляет 2,265 г/см3.
3. Карбин – мелкокристаллический порошок чёрного цвета. В его кристаллической структуре атомы углерода соединены чередующимися одинарными и тройными связями в линейные цепочки:
−С≡С−С≡С−С≡С−
Это вещество впервые получено В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным, Ю.П. Кудрявцевым в начале 60-х годов XX века.
Смотрите также
Хром (Cromium), Cr
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
FeO·Cr2O3 + 4C → ...
Классификации катализаторов
Существуют
различные типы классификации катализаторов, в основе которых лежит определенная
совокупность свойств или характеристик. Наиболее широко используется
классификация по типу веществ ...
