Экспериментальная частьСтатьи / Тест-системы для индикации ионов тяжёлых металлов в объектах окружающей среды / Экспериментальная частьСтраница 1
Получение твёрдофазного носителя, составляющего основу тест-системы для обнаружения ионов никеля, меди и кобальта, осуществляли по схеме, представленной на рисунке 3.
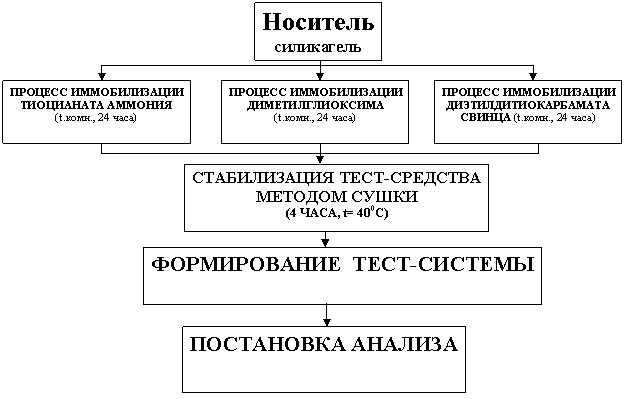

Рисунок 3 – Блок-схема получения тест-системы
Блок-схема включает в себя следующие этапы: нанесение комплексообразователя на поверхность носителя, стабилизация тест-средства методом сушки и формирование тест-системы с учётом специфичности определяемых ионов.
В три химических стакана помещали навеску силикагеля массой по два грамма, приливали реактив Чугаева (10 мл), диэтилдитиокарбамат свинца в четырёххлористом углероде (10 мл) и тиоцианат аммония (10 мл), перемешивали и оставляли на 24 часа при t 20-25°С. После чего, сорбент с иммобилизованными комплексообразователями стабилизировали методом тепловой обработки 8 часов при t 30-35°С.
Для формирования тест-системы было проведено комплексное исследование влияния различных факторов на сорбционную ёмкость, специфичность и чувствительность тест-средства.
Сорбционную ёмкость определяли по количеству связавшегося с носителем определяемого иона из раствора.
Сорбционную ёмкость ионов кобальта определяли колориметрическим методом. Для этого в пять пробирок внесли по 3 мл анализируемого раствора хлорида кобальта с концентрациями: 10 мг/л, 15 мг/л, 20 мг/л, 25 мг/л, 30 мг/л. В каждую пробирку прибавили по 1 мл раствора тиоцианата аммония. Голубая окраска проявлялась в течение 5 минут. На приборе ФЭК КФК-2 измеряли оптическую плотность полученных растворов при длине волны 540 нм и при толщине кюветы 1,040 мм. Стандартом служил раствор, содержащий 3 мл дистиллированной воды и 1 мл тиоцианата аммония. Полученные результаты представлены в таблице 2 и на рисунке 4.
Таблица 2- Оптическая плотность и процент пропускания анализируемых растворов хлорида кобальта в присутствии тиоцианата аммония
|
№ пробирки |
Концентрация анализируемого раствора, мг/л |
D |
T, % |
|
1 |
10 |
0,165 |
69 |
|
2 |
15 |
0,130 |
75 |
|
3 |
20 |
0,120 |
76 |
|
4 |
25 |
0,115 |
77 |
|
5 |
30 |
0,05 |
90 |
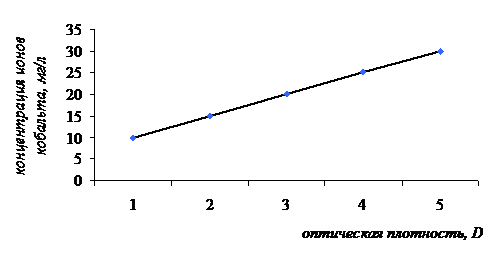
Рисунок 4 - Зависимость оптической плотности раствора хлорида кобальта от его концентрации в присутствии тиоцианата аммония
Сорбционную ёмкость по ионам меди и никеля определяли атомно-абсорбционным методом. Для этого готовили растворы хлорида никеля следующих концентраций: 10,5; 12,4; 17,8; 25,3; 35,0 мг/л. Растворы сульфата меди были следующих концентраций: 11,3; 16,3; 25,4; 34,9 мг/л.
Влияние массы сорбента на сорбционную ёмкость проводили следующим образом. К навеске тест-сорбента определённой массы добавляли раствор анализируемого иона известной концентрации и оценивали величину сорбционной ёмкости. Данные представлены на рисунке 5.
Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации.
У1 = -35,711x3 + 72,202x2 + 3,5789x + 52,813 (для ионов кобальта)
R2 = 0,9981;
У2 = -29,617x3 + 63,305x2 - 7,872x + 69,347 (для ионов никеля)
R2 = 0,9999;
У3 = 61,09x3 - 226,24x2 + 275,44x - 10,297 (для ионов меди)
R2 = 1.
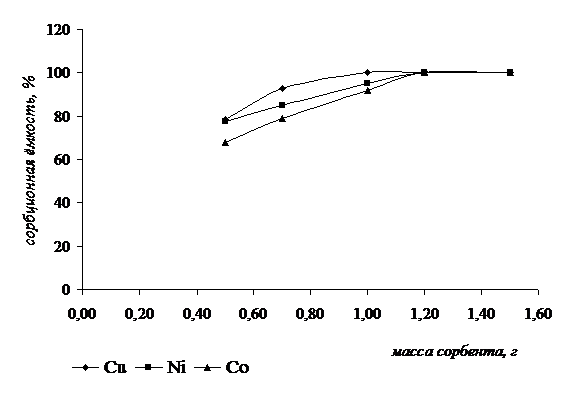
Рисунок 5 – Влияние массы сорбента на сорбционную ёмкость
Из графика видно, что максимальная сорбционная ёмкость по ионам кобальта и никеля наблюдалась при массе сорбента 1,2 г, а по ионам меди – 1г. Выбор концентрации растворов исследуемых ионов для постановки данного анализа был обусловлен валовым содержанием этих элементов в объектах окружающей среды.
Сорбционная ёмкость влияет на длину окрашенной зоны. В основу количественного определения элементов по величине окрашенной зоны положена особенность, связанная с равномерным распределением веществ в зоне, т.е. пропорциональная зависимость между размерами зон и концентрацией исследуемого раствора. Для этого нами было проведено исследование зависимости длины окрашенной зоны от концентрации анализируемого иона в растворе. Сорбент с иммобилизованным комплексообразователем помещали в стеклянную трубку диаметром 10 мм и длиной 100 мм. Через полученную систему пропускали раствор анализируемого иона известной концентрации. Наблюдалось развитие окраски тест-средства в результате взаимодействия комплексообразователя, закреплённого на носителе с исследуемым ионом.
Смотрите также
Крашение натурального шелка активными бромакриламидными ланазолевыми красителями
...
Изотермы адсорбции паров летучих органических веществ на пористых углеродных материалах
Антропогенные
изменения окружающей среды становятся все более значимыми по мере усиления
хозяйственной деятельности человека. Научно – технический прогресс ведет к
заметным, иногда непредск ...
