Теория химического строения
Основы новой теории сформулировован 1861г. профессор Казанского университета Александр Бутлеров.
В химии к тому времени уже значительное распространение получили идеи атомистики. Понят атома и молекулы получили на международном съезде Химиков в 1860г. свое точное определение. Но ученые еще не придавали значения тому, как строятся молекулы из атомное, и считали, что позвать это строение химическими методами невозможно. Были и такие ученые, которые вообще не реального существования атомов и молекул.
А.М. Бутлеров не только считал атомы и молекулы реально существующими частицами веществ, но и пришел к выводу, что атомы в молекулах не находится в беспорядке, а соединены друг с другом в определенной последовательности которую можно установить химическими методами и отразить в формуле.
Основную идею своей теории А.М. Бутлеров выразил в следующих словах: е Химическая натура сосной частицы определяется натурой элементарных составных частей, количеством их и химическим строением». В более привычной для нас формулировке это означает, что химические свойства молекулы определяются свойствами составляющих ее атомов, их числом и химическим строением молекулы,
Химическое строение, по А.М. Бутлерову — это последовательность соединения атомов в молекуле, порядок их взаимосвязи и взаимного влияния друг Руга. Соединения атомов в молекулы, указывал А.М. Бутлеров происходит в соответствии с их атомностью (валентностью).
На примерах из неорганической химии можно видеть, что атомы, соединяясь в Молекулу, оказывают влияние друг на друга. Так, водород и кислород, образовав воду, настолько изменились в результате взаимного влияния, что первый уже Не Роит, а второй не поддерживает горения; вода не Обещает свойствами ни водорода, ни кислорода.
Основывается на приведенных выше высказываниях А. М. Бутлерова, сущность теории химического строения можно выразить в следующих положениях:
• 1. Атомы в молекулах располагаются не беспорядочно, они соединены друг с другом в определенной последовательности согласно их валентности.
• 2. Свойства веществ зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах, от порядка их взаимного влияния друг на друга.
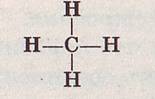
Рассмотрим на примере известных нам углеводородов первое из этих положений. В какой последовательности соединены атомы в молекуле простейшего углеводорода метана? Мы уже знаем, что каждый атом водорода в нем соединен с атомом углерода. Легко понять, что иначе и быть не может. Если, например, предположить, что какие-нибудь два атома водорода связаны друг с другом непосредственно, то, исчерпав при этом свою валентность, они уже не смогут соединяться с другими атомами. Обозначая валентность элементов условно черточками, мы так изображаем порядок связи атомов в молекуле метана:
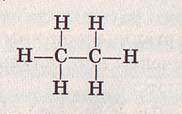
В молекулах пропана С3Н3 и бутана С4Н10 атомы соединены в таком порядке:

Зная строение углеводородов, мы теперь можем ответить на некоторые из тех вопросов, которые волновали в свое время ученых.
В чем причина многообразия соединений углерода? Как видим, она заключается в том, что атомы углерода обладают свойством соединяться друг с другом в цепи.
Нарушается ли валентность элементов в рассмотренных соединениях? Нет, углерод всюду остается четырехвалентным.
• Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются структурными формулами или формулами строения.
Следует иметь в виду, что подобные формулы отображают только последовательность соединения атомов, но не показывают, как атомы расположены в пространстве. Поэтому, как бы мы ни изобразили структурную формулу пропана:это будет одна и та же молекула, так как порядок, последовательность соединения атомов не изменяется.
Структурные формулы веществ часто изображают в сокращенном виде, например: СН3—СН2—Сн3. В сокращенных структурных формулах черточки обозначают связь атомов углерода между собой, но не показывают связи между атомами углерода и водорода.
Смотрите также
Производство серной кислоты из серы
...
Осветительные приборы аварийного освещения
Охранное освещение должно предусматриваться вдоль границ территорий, охраняемых в ночное время. Освещенность должна быть не менее 0,5 лк на уровне земли в горизонтальной плоскости или на уровне 0,5 м ...
Исследования в области синтеза и переработки полиэтилентерефталата и нанокомпозитов на его основе
...
