Правило 18 электроновСтатьи / Теория молекулярных орбиталей в комплексных соединениях / Правило 18 электроновСтраница 2
Правило 18 электронов имеет немало исключений, и его следует рассматривать только как один из факторов, способствующих образованию стабильной структуры координационного соединения. Отклонения от правила связаны часто с пространственными ограничениями, не допускающими координации центральным атомом необходимого для заполнения 18-электронной оболочкой числа лигандов. Например, ясно, что ион V3+ (d2) должен координировать восемь двухэлектронных лигандов, чтобы заполнить валентную оболочку полностью. Однако пространственные возможности допускают только октаэдрическую координацию. Особенно важным отклонением от требований правила 18 электронов являются плоскоквадратные тетракоординированные и плоские трикоординированные комплексы. Как следует из схемы орбитальных взаимодействий, приведенной на рис. 18, а—в, в обоих этих случаях рz -АО центрального атома остается отключенной от связывания с лигандами, так как ее узловая плоскость совпадает с плоскостью, в которой располагаются оси сигма-орбиталей лигандов L. Из рисунка следует, что при этом образуется в сумме только восемь связывающих и несвязывающих орбиталей комплекса, на которых могут разместиться лишь 16 электронов. Следовательно, в случае плоских тетра- и трико-ординированных структур переходных металлов устойчивой является 16-электронная конфигурация.
Действительно, рассмотрим электронную конфигурацию центрального атома Pt в соли Цейзе XXV. Этиленовый пи-лиганд и три сигма-лиганда С1- дают каждый по два электрона, т. е. всего восемь электронов, в валентную оболочку. Учитывая заряд комплексного аниона —1, заряд центрального иона (или число окисления центрального атома) определяют как — 1 —(—3)= +2. Ион Pt2+(d8) дает в валентную оболочку восемь электронов. Общая сумма валентных электронов, определяемая таким образом, равна 16 (8 + 8). Шестнадцать электронов содержатся также в валентных оболочках плоских трикоординированных комплексов [Fe (SiNMe2)3], XXVII, и др.
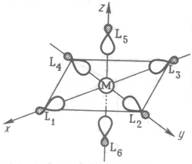
Рис. 1.
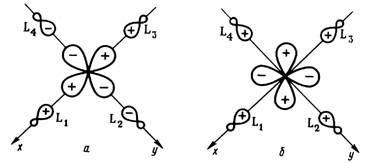
Рис. 2.
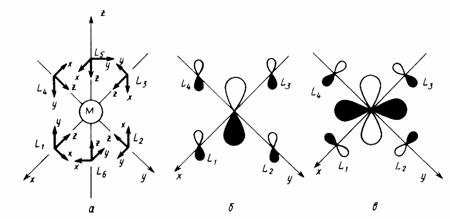
Рис.4.
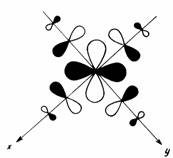
Рис. 5.
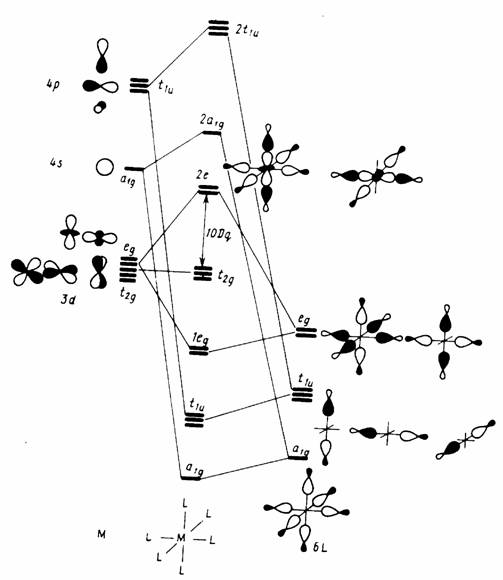
Рис. 3.
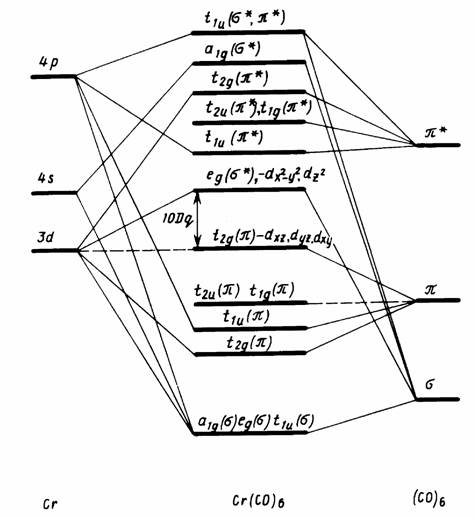
Рис. 6.
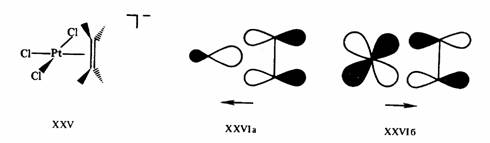
Рис. 7.
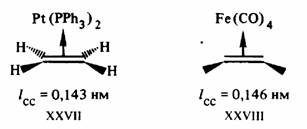
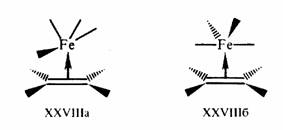
Рис. 8. Рис. 9.
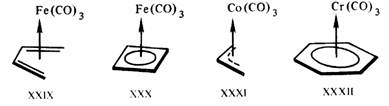
Рис. 10.
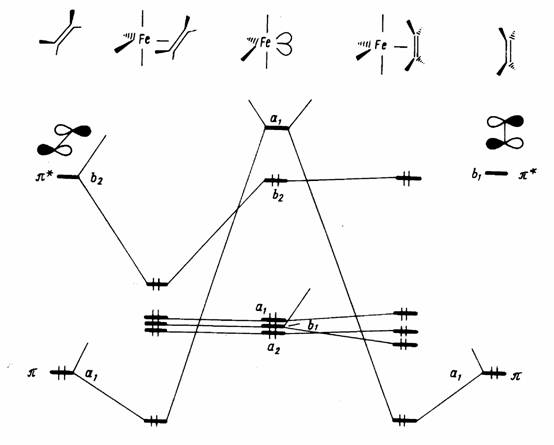
Рис. 11.
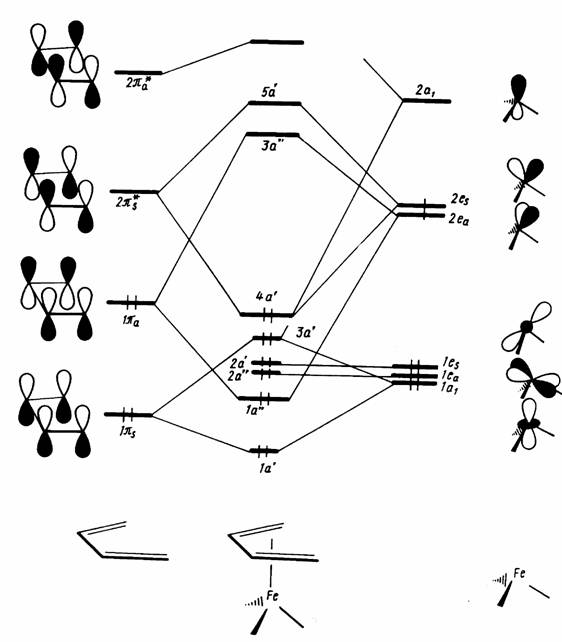
Рис. 12.
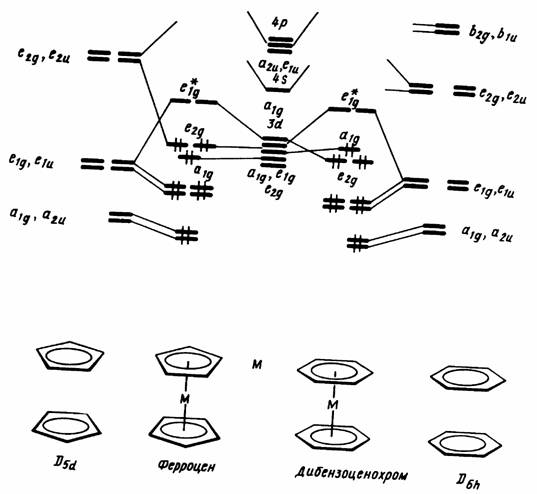
Рис. 13.
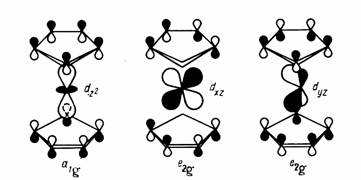
Рис. 14.
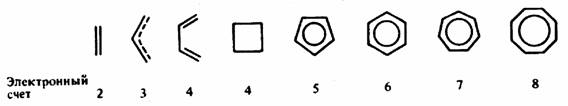
Рис. 15.
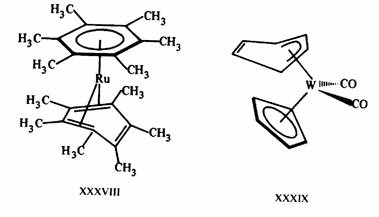
Рис. 16.
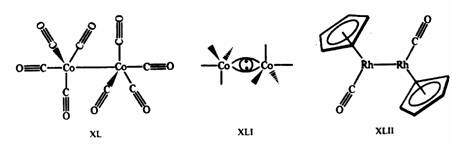
Рис. 17.
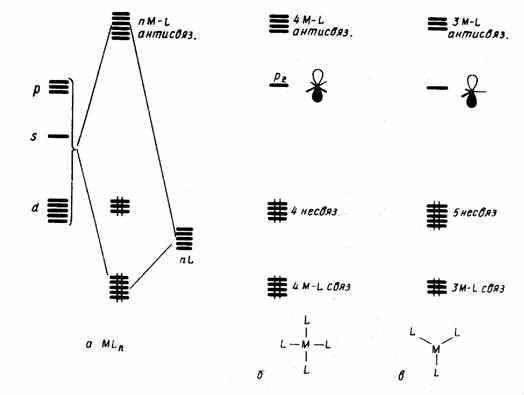
Рис. 18.
Смотрите также
Системы регистрации и обработки данных
...
Соответствие между молекулами и группами симметрии
Каждая молекула может быть отнесена к одной из
точечных групп 14 типов. Эти точечные группы состоят из строго
определенных операций симметрии и никакие другие точечные группы невозможны. Одн ...
Радон (Radonum), Rn
Радон - радиоактивный химический элемент VIII группы периодической системы Менделеева; атомный номер 86, относится к инертным газам. Три a-радиоактивных изотопа Р. встречаются в природе как члены есте ...
