Нахождение единой кислотности рА с помощью протоновСтатьи / Стандартизация измерения рН в неводных средах. Методы определения рН стандартных буферных растворов / Нахождение единой кислотности рА с помощью протоновСтраница 1
Все перечисленные выше методы не позволяют однозначно оценить кислотность неводных растворов в единой шкале. Вопрос об этой шкале может быть решен только на основании данных о величинах химической энергии сольватации протонов в различных растворителях. Эти данные получены на основании подсчетов сумм и разностей химических энергий сольватации ионов в неводных растворах из данных об электродвижущих силах цепей без переноса и с переносом в неводных растворах. Путем экстраполяции величин суммарной энергии сольватации ионов водорода и ионов галогенов (ионы галогеноводородных кислот) и разностей энергий сольватации ионов водорода и ионов щелочных металлов была определена энергия сольватации протона и других ионов в различных растворителях.
При переходе от водного к неводному раствору следует считаться с том, что протяженность шкалы различна для разных растворителей. Для того чтобы оценить абсолютную кислотность, кроме протяженности шкалы нужно знать, как смещено начало шкалы кислотности одного растворителя но отношению к шкале кислотности воды.
Использование ![]() протонов в различных растворителях в качестве единой меры изменения кислотности в разных растворителях однозначно характеризует величину смещения шкал кислотности.
протонов в различных растворителях в качестве единой меры изменения кислотности в разных растворителях однозначно характеризует величину смещения шкал кислотности.
Обозначим начало шкалы для воды через 0; шкала для этилового спирта имеет протяженность 19,3; если ![]() = 4,2, то очевидно, что шкала в этиловом спирте начинается в области —4,2 и заканчивается при рА = 15,1. У метилового спирта
= 4,2, то очевидно, что шкала в этиловом спирте начинается в области —4,2 и заканчивается при рА = 15,1. У метилового спирта ![]() = 3,3, а вся шкала 16,9; шкала для него расположится от - 3,3 до +13,6;
= 3,3, а вся шкала 16,9; шкала для него расположится от - 3,3 до +13,6; ![]() в муравьиной кислоте
в муравьиной кислоте ![]() = 8,6, вся шкала равна 6,1, она расположена между -8,6 и -2,5. У аммиака протяженность шкалы 32,7; она смещена по отношению к воде на 16,4 единицы, начало шкалы будет при рА = 16,4, а конец при рА = 49,1. Из этих сопоставлений следует, что самый щелочной раствор в муравьиной кислоте будет кислее самого кислого раствора в воде и самый кислый раствор в аммиаке щелочнее самого щелочного раствора в воде,
= 8,6, вся шкала равна 6,1, она расположена между -8,6 и -2,5. У аммиака протяженность шкалы 32,7; она смещена по отношению к воде на 16,4 единицы, начало шкалы будет при рА = 16,4, а конец при рА = 49,1. Из этих сопоставлений следует, что самый щелочной раствор в муравьиной кислоте будет кислее самого кислого раствора в воде и самый кислый раствор в аммиаке щелочнее самого щелочного раствора в воде,
Относительное расположение шкалы рНр позволяет оценить отношение между единой кислотностью растворов и величиной рНр. Из рис. 2 следует, что раствор кислоты в спирте, в котором активность а*= (рНр= 0), кислее соответствующего йодного раствори на 4,2 единицы.
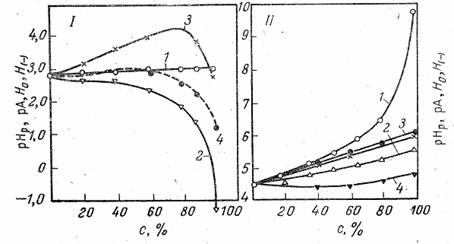
Рис. 2. Изменение рНр (1), рА (2), Н0 (3), и Н(-) (4) растворов HCl (I), и ацетатного буфера (II) в растворах этилового спирта в воде.
Однако не нужно думать, что всякий раствор кислоты в этиловом спирте будет кислее, чем в воде. В действительности рА нормального раствора соляной кислоты в этиловом спирте не будет равна -4,2, так как в нем величина ![]() значительно меньше величины
значительно меньше величины ![]() в воде.
в воде.
Таким образом, в этиловом спирте, с одной стороны, ![]() положителен, и это приводит к уменьшению рА и увеличению кислотности. С другой стороны, lg
положителен, и это приводит к уменьшению рА и увеличению кислотности. С другой стороны, lg ![]() отрицательны и по абсолютной величине больше, чем у воды, а это приводит к увеличению рНр и к уменьшению кислотности. В 1 н. растворе HCl в этиловом спирте величина
отрицательны и по абсолютной величине больше, чем у воды, а это приводит к увеличению рНр и к уменьшению кислотности. В 1 н. растворе HCl в этиловом спирте величина ![]() = 0,157. В результате этого рА 1 н раствора HCl в этиловом спирте будет не -4,2, а значительно меньше (только -3,3), но все же раствор в этиловом спирте значительно кислее, том в воде.
= 0,157. В результате этого рА 1 н раствора HCl в этиловом спирте будет не -4,2, а значительно меньше (только -3,3), но все же раствор в этиловом спирте значительно кислее, том в воде.
Смотрите также
Электрохимическая коррозия.
Электрохимическая коррозия является наиболее
распространенным типом коррозии металлов. По электрохимическому механизму
коррозируют металлы в контакте с растворами ...
Получение и применение стекла
...
Крашение натурального шелка активными бромакриламидными ланазолевыми красителями
...
