Термодинамика процессаСтатьи / Сравнительный анализ: методы получения синтез-газа / Термодинамика процессаСтраница 1
Равновесие в системе 2CO + 2H2 ↔ CH4 + CO2
Большие трудности в практическом осуществлении всех методов конверсии метана связаны со значительным тепловым эффектом: как эндотермичность реакций (1) и (3), так и экзотермичность реакции (2) создают проблему подвода или отвода тепла. В углекислотной конверсии метана (3) при 700 - 800 °С на многих никелевых и платиновых катализаторах достигается равновесная конверсия в синтез-газ СО + Н2. В этих условиях одновременно с реакцией (3) осуществляется взаимодействие монооксида углерода с водяным паром (6). Протекание реакции (6) приводит к тому, что в равновесии (3) отношение СО:Н2 оказывается меньше 1, а конверсия СО2 больше конверсии СН4. Лишь при 900 °С и атмосферном давлении выход Н2 и СО приближается к 100%, а отношение Н2О/СО к нулю.
На рис. 11 показана зависимость равновесного выхода Н2 и СО в исходной системе CH4 + CO2 от температуры и давления.
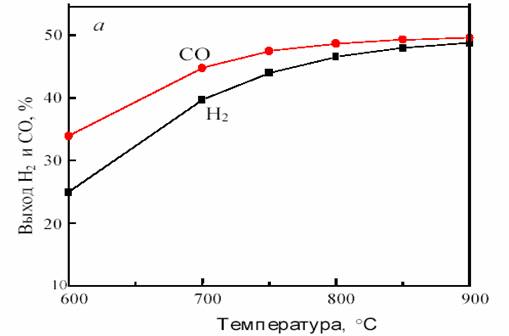
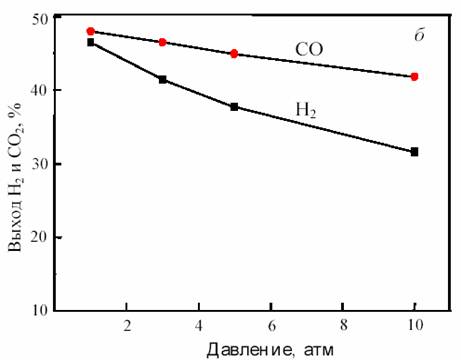
Рис. 11. Зависимость равновесного выхода Н2 и СО от температуры при 0,1 МПа (а)
и от давления при 800 °С (б) в исходной смеси 1СН4:1СО2
Как видно из рис. 11, с повышением температуры выход водорода и CO возрастает, достигая предела вблизи 900 °С. С ростом давления равновесная конверсия уменьшается.
Основным препятствием к использованию Ni-катализаторов отравляемость коксом. Возможны два пути образования кокса при разложении метана:
· диссоциация метана
СН4 = С + 2Н2
ΔН = +74,8 кДж/моль•С (8)
· реакция Будуара
2CO ↔ C + CO2
ΔН = -172,5 кДж/моль•С (9)
Первая из них ─ эндотермическая, вторая ─ экзотермическая. Обе реакции могут быть представлены как стадии суммарной реакции (3). Однако в реальности они протекают при разных температурах: реакция (8) ─ преимущественно при высоких температурах, реакция (9) ─ при низких температурах, и в реальных условиях кокс почти всегда образуется. Согласно термодинамическим соображениям суммарное углеотложение должно снижаться с повышением температуры. Действительно, эксперимент подтверждает, что основное количество углерода образуется по реакции (8), а не (9). Часто углерод, диффундируя в металл, образуется на выходе из катализатора в виде нитей.
Одним из путей решения проблемы, связанной с подводом и отводом тепла при получении синтез-газа, является разработка процесса комбинированной конверсии смеси СН4 + СО2 + Н2О + О2, в котором бы без дополнительного подогрева сочетались реакции (1), (2), (3) и (6). Такую термонейтральную (автотермическую) конверсию можно осуществить, комбинируя углекислотную (3) и кислородную (2) конверсию метана в системе СН4 + СО2 + О2. Термодинамический расчет процесса комбинированной конверсии, включающей реакции (2), (3) и паровой конверсии СО (6), показывает, что в смеси 50% СН4 + (50 - х)% СО2 + х% О2 при 800 °С термонейтральность достигается при х = 23% (рис. 12). В реакции смеси 50% СН4 + 27% СО2 + 23% О2 при 800 °С и 1 атм. равновесные выходы составляют: 49,3% Н2 и 36,5% СО, т.е. соотношение CO:H2 сильно отличается от единицы.
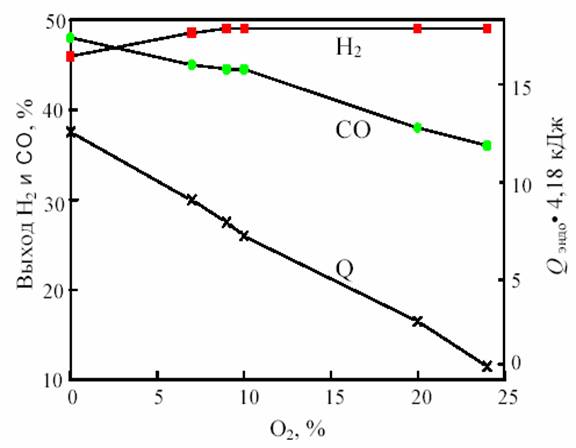 |
Рис. 12. Зависимость равновесного выхода Н2 и СО и теплового эффекта реакции (теплопоглощения) Qэндо при 800 °С и 0,1 МПа от содержания кислорода (x) в смеси 50% СН4 + (50-х)% СО2 + х% О2
Смотрите также
Палладий (Palladium), Pd
Открыт английским химиком Вильямом Волластоном (William Hyde Wollaston) в 1803 году. Волластон выделил его из платиновой руды привезённой из Южной Америки.
Для выделения элемента Волластон растворил ...
Коллоидная химия и поверхностные явления
...
Теория МОХ
Тема: Расчёты по методу МО
ЛКАО. Простой метод Хюккеля
для -систем. Углеводороды с сопряжёнными связями.
Цель занятия: Ознакомление с простейшим вариантом
метода МО ЛКАО.
...
