Товарные и технологические свойства азотной кислотыСтатьи / Производство азотной кислоты / Товарные и технологические свойства азотной кислоты
Безводная азотная кислота (моногидрат HNO3) представляет бесцветную жидкость с температурой кристаллизации -41,6°С, температурой кипения — 82,6°С и плотностью — 1,513 г/м3. Смешивается с водой во всех отношениях, образуя при этом индивидуальные соединения — гидраты состава HNO3·Н2О и HNO3 · 3Н2О, которые дают три эвтектики (рис. 1.1).
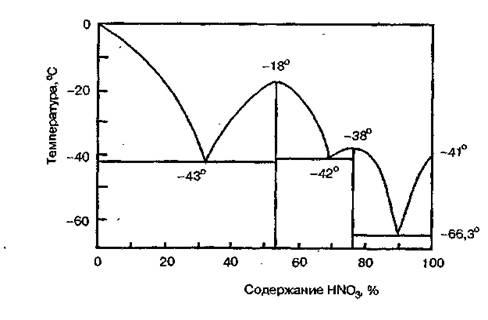
Рис. 1.1 Диаграмма кристаллизации системы «HNO3 – NO2»
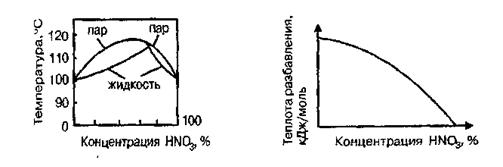
Температура кипения водных растворов азотной кислоты зависит от их концентрации. С увеличением концентрации температура кипения возрастает, достигая максимума 120,7°С при азеотропном составе кислоты 68,4% (масс.), после чего снижается (рис. 1.2). Это имеет существенное значение для концентрирования азотной кислоты.
![]()
Теплота разбавления азотной кислоты водой существенно меняется с ее концентрацией и составляет для моногидрата HNO3 33,68 кДж/моль (рис. 1.3). Безводная азотная кислота малоустойчива термически и разлагается уже при хранении по уравнению:
|
|
Рис. 1.2. Диаграмма кипения Рис. 1.3. Теплота разбавления
системы HNO3 – Н2О азотной кислоты
Скорость разложения возрастает с повышением концентрации; для 99%-ной кислоты температурный градиент составляет всего 5°С.
При нагревании процесс ускоряется и протекает по уравнению:
![]()
Выделяющийся оксид азота (IV) растворяется в кислоте и окрашивает ее в желто-оранжевый цвет. Для удаления оксида из кислоты в технологическом процессе ее производства предусмотрена операция «отбелки» кислоты.
При растворении оксида азота (IV) в кислоте образуется соединение состава HNO3·NO2 (нитроолеум), являющийся промежуточным продуктом в прямом синтезе азотной кислоты.
Азотная кислота корродирует и растворяет все металлы кроме золота, платины, титана, тантала, родия и иридия, однако в концентрированном виде пассивирует железо и его сплавы.
Области применения азотной кислоты весьма разнообразны. Большая часть ее (до 75—80%) расходуется на производство азотных и комплексных минеральных удобрений и разнообразных нитратов, 10—15% идет на получение взрывчатых веществ и ракетного топлива, остальное количество потребляется производством красителей, органическим синтезом и в цветной металлургии (травление металлов).
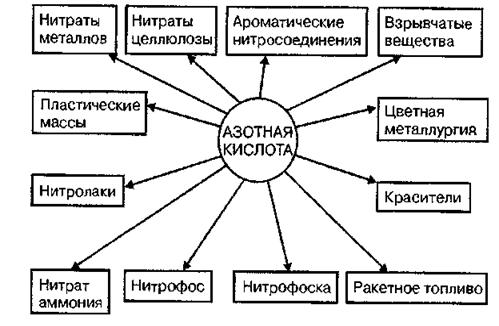
Рис. 1.4. Области применения азотной кислоты.
Смотрите также
Бром (Bromum), Br
Бром - химический элемент VII группы периодической системы Менделеева, относится к галогенам; атомный номер 35, атомная масса 79,904; красно-бурая жидкость с сильным неприятным запахом. Б. откры ...
Курсовая работа по химии. Медь
...
Химия и технология штатных бризантных взрывчатых веществ
Химические
соединения или их смеси, которые содержат в молекулах определенный запас
химической энергии, называют энергонасыщенными веществами. Эта энергия под
действием внешнего импульса в ...