Теория
ковалентной связи. Метод молекулярных орбиталей (МО).Статьи / Применение сингулярной матрицы в химии / Теория
ковалентной связи. Метод молекулярных орбиталей (МО).Страница 1
Метод МО начал разрабатываться в 30-х годах ХХ века в работах ряда ученых (Гунд, Малмекен и др.). В этом методе каждый электрон рассматривается движущимся в поле всех электронов и всех ядер молекулы. Как и в других методах квантовой химии при этом используется одноэлектронное приближение, согласно которому каждый электрон описывается отдельной волновой функцией, а из них составляется полная волновая функция молекулы. Одновременно учитывается адиабатическое приближение Борна-Оппенгеймера
; движение электронов молекулы ввиду относительной замедленности колебательных движений массивных ядер рассматривается в поле фиксированных ядер.
Для построение молекулярных орбиталей используется вариант метода, называемый линейной комбинацией атомных ордиталей – молекулярные орбитали (ЛКАО – МО)
. В его основе лежит способ получения одноэлектронных молекулярных орбиталей (МО) в виде линейной комбинации атомных орбиталей (ЛКАО). Если по-прежнему для двухатомной молекулы (например, Н2) обозначить волновые функции атомов φа и φb (атомные орбитали), то в общем виде их линейные комбинации будут описывать движение каждого электрона в молекуле следующим образом:
![]() ,
,
где і – номер МО;
j – номер АО;
сj – изменяемые параметры, учитывающие долю каждой из суммируемых орбиталей (находятся из условия минимума энергии).
Далее в методе МО допускается, что волновая функция, описывающая состояние многоатомной молекулы, может быть представлена как произведение волновых функций одноэлектронных МО:
ψI = ψ1ψ2 = [φa(1) + φb(1)] [φа(2) ∙ φb(2)].
Таким образом, состояние молекулы Н2 в методе МО определяется совокупностью ряда слагаемых:
ψI = φa(1)∙φb(2) + φа(2)∙φb(1) + φа(1)∙φа(2) + φb(1)∙φb(2)
Сравнение последнего соотношения с применявшимися в методе ВС функциями ψ± показывает, что в методе МО волновая функция ψI отличается третьим и четвертым членом. Оба эти члена характеризуют случаи, когда два электрона находятся либо у одного, либо у другого ядра, т.е. соответствуют ионным состояниям молекулы На- – Нb+ и На+ – Нb-. В действительности роль таких состояний в характеристике МО невелика и составляет около 6 % от энергии обменного взаимодействия, которым определяется ковалентная связь.
Последующие расчеты в методе МО, как и в методе ВС, направлены на определение энергии системы. Здесь так же, как и в методе ВС, получают два значения (уровня) энергии. Первый уровень отвечает соединению атомов и образованию химической связи, поэтому первая орбиталь называется связывающей
. Второй уровень характеризует отталкивание, и соответствующая орбиталь называется разрыхляющей
. Схема образования химической связи в молекуле Н2 в методе МО изображена на рис. 2.
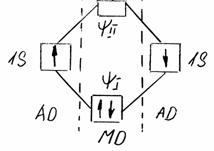
Рис. 2. Схема образования ковалентной связи в Н2.
На рисунке показано, что образование химической ковалентной связи происходит за счет спаривания двух электронов с противоположной ориентацией спинов. Ячейка, соответствующая состоянию этих электронов, расположена ниже ячеек АО, так как энергия МО ψІ меньше, чем у исходных АО. В то же время энергия МО ψІІ больше и ячейка свободна от электронов. При возбуждении молекулы и появлении на верхней МО так называемых разрыхляющих электронов система распадается на отдельные атомы.
Для составления схем образования химических связей более сложных молекул необходимо руководствоваться рядом положений. Во-первых, принцип построения АО повторяет картину заполнения электронных оболочек в атомах. В соответствии с принципом Паули и правилом Гунда заполнение электронами начинается с низшей АО.
В образовании химической связи участвуют лишь валентные электроны. Во-первых, число МО в сложной молекуле увеличивается пропорционально числу атомов в молекуле. В общем случае при использовании NАО образуется NМО. Из них всегда N/2 является связывающими МО и N/2 – разрыхляющими МО. Кратность связи устанавливается избытком числа связывающих электронов (т.е. разностью между количеством связывающих и разрыхляющих электронов), поделенной на 2.
Рассмотрим более сложный случай образования МО на примере молекулы кислорода. Здесь два разрыхляющих электрона расположены на вырожденном уровне π*2р. В соответствии с правилом Гунда они неспарены и имеют параллельные спины. Подсчет кратности связи дает валентность 2, однако из рисунка видно, что обычно принимаемая валентная схема О = О неверна.
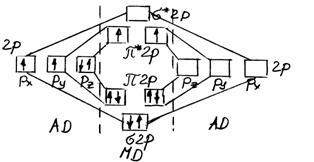
Рис. 3 Схема образования МО в молекуле О2.
В действительность в молекуле О2 в основном ее состоянии двойная связь образуется из трехкратной за счет ее разрыхления двумя электронами. Отсюда видно, что молекула О2 имеет два свободных электрона. Следовательно, кислород должен обладать парамагнитными свойствами. Этот вывод вполне согласуется с опытом.
Смотрите также
Теория молекулярных орбиталей в комплексных соединениях
Наиболее
общий подход к рассмотрению электронной структуры комплексов связан с
расчетами полных волновых функций комплекса как единого целого, а не только
центрального иона п ...
Изучение возможности применения магнитных жидкостей для синтеза магнитных сорбентов
Данная
дипломная работа посвящена синтезу и изучению магнитных сорбентов,
представляющих собой магнитный (либо намагниченный) материал с высокими
адсорбционными свойствами.
Преимущество
...
Спроектировать ректификационную установку для разделения бензол – толуол
...
