Ионная
(гетерополярная) связь. Расчет энергии ионной связи.Статьи / Применение сингулярной матрицы в химии / Ионная
(гетерополярная) связь. Расчет энергии ионной связи.
В зависимости от свойств элементов образующие химическую связь электроны могут находиться в различных энергетических и пространственных состояниях, в результате чего в молекулах возникают разные типы связей. С целью классификации выделяют обычно два основных типа связи – ионную и ковалентную. Однако это разделение условно и не отражает многообразия форм химического движения.
Связь называется ионной
в том случае, когда между двумя атомами или группами атомов сильно преобладает электростатическое взаимодействие.
Сродством атома к электрону
называется количество энергии Е, которое выделяется при присоединении электрона к нейтральному атому или отрицательному иону
![]()
Полусумма энергии ионизации J и энергии сродства к электрону Е, называется электроотрицательностью χ атома, т.е. χ= ½ (
J+
E).
Энергия ионизации и сродство к электрону могут быть вычислены квантово-механическим путем для конкретных оболочек атомов, т.е. с учетом степени гибридизации связей и заселенности орбиталей. В связи с этим все шире используется понятие орбитальной электроноотрицательности (ОЭО)
, с помощью которого оценивается способность атома в молекуле к притяжению электрона на данную орбиталь. Метод ЭО позволяет рассчитать эффективные заряды, которые определяются только нормальными валентными связями атомов. В случае дополнительных эффектов (водородные связи, трансвлияние, дативное взаимодействие и т.п.) вычисленные значения зарядов атомов могут существенно отличаться от экспериментальных.
Энергию образования U гетерополярного соединения из атомов можно найти теоретически. Энергия молекулы как функция расстояния r между одновалентными ионами выражается уравнением:
![]()
В этом уравнении разность энергии ионизации первого атома J1 и энергии сродства к электрону второго атома Е2 выражает энергию образования ионов. Энергия электростатического притяжения ионов представлена отрицательным значением члена е2/r, а энергия отталкивания – функцией b2/r (обусловлена взаимодействием заполненных электронных оболочек). Постоянная n определяется сжимаемостью кристаллического вещества и обычно равна 10. Значение b можно рассчитать из равновесного значения энергии (минимум энергии, когда r = r0):
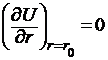 и, следовательно,
и, следовательно,
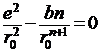 , откуда
, откуда ![]()
Используя это значение b, получим энергию молекулы в равновесном состоянии:
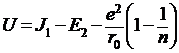 (9)
(9)
Величины, входящие в это уравнение, определяются с помощью спектральных и рентгенографических измерений.
Смотрите также
Использование отходов сельскохозяйственного производства
Наличие большого количества
отходов химической промышленности, сельскохозяйственного производства,
различных видов бытовых отходов может быть неплохой альтернативой традиционным
наполнителя ...
Металлы в периодической системе Д.И. Менделеева
...
Иод (Iodum), I
Иод - химический элемент VII группы периодической системы Менделеева, относится к галогенам (в литературе встречается также символ J); атомный номер 53, атомная масса 126,9045; кристаллы черно-серого ...
