Основы
квантовой механики атома. Соотношение де Бройля. Уравнение Шредингера.Статьи / Применение сингулярной матрицы в химии / Основы
квантовой механики атома. Соотношение де Бройля. Уравнение Шредингера.Страница 1
Химические процессы сводятся к превращению молекул, т.е. к возникновению и разрушению связей между атомами. Поэтому важнейшей проблемой химии всегда была и остается проблема химического взаимодействия, тесно связанная со строением и свойствами вещества. Современная научная трактовка вопросов химического строения и природы химической связи дается квантовой
механикой
– теорией движения и взаимодействия микрочастиц (электронов, ядер и т.д.).
Одним из общих свойств материи является ее двойственность. Частицы материи обладают одновременно и корпускулярными и волновыми свойствами. Соотношение "волна – частица" таково, что с уменьшением массы частицы ее волновые свойства все более усиливаются, а корпускулярные – ослабевают. Когда же частица становится соизмеримой с атомом, наблюдаются типичные волновые явления. Одновременно оказывается невозможным описание движения и взаимодействия микрочастиц-волн законами движения тел с большой массой. Первый шаг в направлении создания волновой, или квантовой механики, законы которой объединяют и волновые, и корпускулярные свойства частиц, сделал де Бройлем (1924). Де Бройль высказал гипотезу, что с каждой материальной частицей связан некоторый периодический процесс. Если частица движется, то этот процесс представляется в виде распространяющейся волны, которую называют волной де Дройля
, или фазовой волной
. Скорость частицы V связана с длиной волны λ соотношением де Бройля
:
![]() (1)
(1)
где m – масса частицы (например, электрона);
h – постоянная Планка.
Уравнение (1) относится к свободному движению частиц. Если же частица движется в силовом поле, то связанные с ней волны описываются так называемой волновой функцией
. Общий вид этой функции определил Шредингер (1926). Найдем волновую функцию следующим путем. Уравнение, характеризующее напряженность поля Еа плоской монохроматической волны света, можно записать в виде:
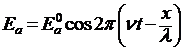 , (2)
, (2)
где Еа0 – амплитуда волны;
ν – частота колебаний;
t – время;
λ – длина волны;
х – координата в направлении распространения волны.
Так как вторые производные от уравнения плоской волны (2), взятые по времени t и координате х, равны соответственно:
![]() , (3)
, (3)
![]() , (4)
, (4)
то ![]()
Подставляя λ=с/ V (с – скорость света), получаем волновое уравнение для плоской световой волны:
![]() , (5)
, (5)
Последующие преобразования основываются на предположениях, что распространение волн де Бройля описывается аналогичным уравнением, и что эти волны становятся стационарными и сферическими. Сначала представим, что по уравнению (5) изменяется значение новой функции ψ от координат (χ, y, z), имеющей смысл амплитуды некоторого колебательного процесса. Тогда, заменяя Еа на ψ, получим волновое уравнение в форме:
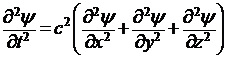 , (6)
, (6)
После исключения t (с помощью (3)) волновое уравнение примет вид:
![]() , (7)
, (7)
где ψ – так называемая волновая функция
– величина, периодически изменяющаяся по закону гармонического движения;
ν2 – оператор Лапласа, означающий, что над функцией производится следующее действие:
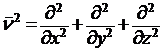 .
.
Будем считать, что волновое уравнение (7) описывает движение частицы. Тогда λ
– длина фазовой волны
, а ψ
– амплитуда фазовой волны
в любой произвольно взятой точке χ, y, z, характеризующей местоположение частицы. Длину и амплитуду фазовой волны можно связать с массой и энергией частицы. Если частица движется в потенциальном поле, то ее полная энергия Е складывается из кинетической энергии Ек = mV2/2 и потенциальной энергии Еп. Отсюда
½mV2 – Е – Еп или m2V2 = 2m(E – Eп).
Учитывая соотношение де Бройля, запишем
m2V2 = h2/λ2 и λ2 = h2/2m (E – Eп)
и представим волновое уравнение в следующем виде:
![]() (8)
(8)
В этой форме волновое уравнение называется уравнением Шредингера
