Применение потенциометрического и кулонометрического методов анализа в фармации и аналитической химииСтатьи / Применение потенциометрического и кулонометрического методов анализа в фармации и аналитической химииСтраница 2
Исходя из данных этой таблицы получим следующий график:
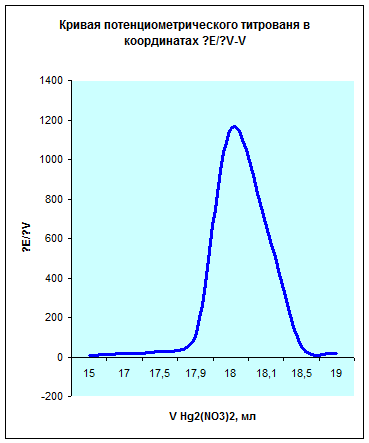
Из данных графиков видно, что точка эквивалентности соответствует 18мл Hg2(NO3)2. Отсюда можно рассчитать концентрацию хлорид кальция в растворе.
Уравнение реакции имеет следующий вид:
CaCl2+ Hg2(NO3)2® Hg2Cl2+Ca(NO3)2
m(Hg2(NO3)2)=Cн(Hg2(NO3)2)*Mэ(Hg2(NO3)2)*V(Hg2(NO3)2)
Нормальность данного раствора дана в условии задачи, объем определили по графику, осталось рассчитать Mэ.
Молярная масса эквивалента соли равна отношению мольной массы соли к произведению числа атомов металла на его валентность. Т.е., получим:
Mэ(Hg2(NO3)2)=![]() =131,5г/моль. Следовательно,
=131,5г/моль. Следовательно,
m(Hg2(NO3)2)=0,05*131,5*18*10-3=0,12г
CaCl2 и Hg2(NO3)2 реагируют в эквивалентном количестве, т.е. в реакцию вступает одинаковое количество молей этих веществ.
n(Hg2(NO3)2)= m(Hg2(NO3)2)/ M(Hg2(NO3)2)=0,12/586=0,2*10-3 моль. Значит, n(CaCl2) также равно 0,2*10-3 моль.
m (CaCl2)=n(CaCl2)*M(CaCl2);
m (CaCl2)= 0,2*10-3*111=0,022 г – это масса в 200 мл, следовательно масса в литре раствора составит: 0,022*5=0,11г
Т.е. концентрация хлорида кальция в растворе составит 0,11 г/л.
Ответ: с(CaCl2)= 0,11 г/л.
4. При фотометрировании раствора сульфосалицилатного комплекса железа получили относительную оптическую плотность раствора 0,55. Раствор сравнения содержал 0,0288 мг железа в 25 мл. Толщина поглощающего слоя 2 см. Определить концентрацию и массу железа в 100 мл анализируемого раствора, если ε комплекса в этих условиях равен 3000 л/(моль·см).
D=eDcl, где e - коэффициент пропорциональности, который не зависит от концентрации, а зависит только от природы растворенного вещества;
Dc=с1-с0 – разность между концентрциями исследуемого раствора и эталонного;
l – толщина поглощающего слоя.
Отсюда, с1=D/(e*l)+ с0
Для начала необходимо вычислить с0.
Если в 25мл – 0,0288 мг, то
в 1000мл - х. х=1000*0,0288/25=1,15мг=1,15*10-3г,следовательно с0=1,15*10-3г/л
Однако необходима концентрация в моль/л.
n0=m0/M0; n=(1.15*10-3г)/56=0,02*10-3моль, следовательно с0=0,02*10-3моль/л.
с1=(0,55/(3000*2))+0,02*10-3=1,1*10-3моль/л
m1=n1*M1; m1=1.1*10-3моль/л*56=61,6мг
Т.е. с1=61,6мг/л
В 100 мл раствора масса железа будет в 10 раз меньше, т.е. будет составлять 61,6/10=6,16 мг.
Ответ: с1=61,6мг/л; m в 100 мл =6,16 мг.
5. Газовая хроматография. Сущность метода. Параметры удерживания
.
Газовой хроматографией называется хроматографический метод, в котором в качестве подвижной фазы применяется газ или пар. В свою очередь газовая хроматография может быть разделена на газо-адсорбционную (газо-твердую) и газо-жидкостную. В первом случае неподвижной фазой служит твердое вещество — адсорбент, во втором — жидкость, распределенная тонким слоем по поверхности какого-либо твердого носителя (зерненого материала, стенок колонки).
Газоадсорбционная хроматография
Особенность метода газоадсорбционной хроматографии (ГАХ) в том, что в качестве неподвижной фазы применяют адсорбенты с высокой удельной поверхностью (10—1000 м2г-1), и распределение веществ между неподвижной и подвижной фазами определяется процессом адсорбции. Адсорбция молекул
из газовой фазы, т.е. концентрированно
их на поверхности раздела твердой и газообразной фаз, происходит за счет межмолекулярных взаимодействий (дисперсионных, ориентационных, индукционных), имеющих электростатическую природу. Возможно, образование водородной связи, причем вклад этого вида взаимодействия в удерживаемые объемы значительно уменьшается с ростом температуры.
Для аналитической практики важно, чтобы при постоянной температуре количество адсорбированного вещества на поверхности Сs было пропорционально концентрации этого вещества в газовой фазе Сm:
Cs = кcm,,
т.е. чтобы распределение происходило в соответствии с линейной изотермой адсорбции (к — константа). В этом случае каждый компонент перемещается вдоль колонки с постоянной скоростью, не зависящей от его концентрации. Разделение веществ обусловлено различной скоростью их перемещения. Поэтому в ГАХ чрезвычайно важен выбор адсорбента, площадь и природа поверхности которого обусловливают селективность (разделение) при заданной температуре.
С повышением температуры уменьшаются теплота адсорбции DH/T, от которой зависит удерживание, и соответственно tR . Это используют в практике анализа. Если разделяют соединения, сильно различающиеся по летучести при постоянной температуре, то низкокипящие вещества элюируются быстро, высококипящие имеют большее время удерживания, их пики на хроматограмме будут ниже и шире, анализ занимает много времени. Если же в процессе хроматографирования повышать температуру колонки с постоянной скоростью (программирование температуры), то близкие по ширине пики на хроматограмме будут располагаться равномерно.
Смотрите также
Исследование свойств чая
Чай —
один из самых древних напитков, известных человечеству. Сегодня чай стал
неотъемлемой частью многих культур, однако достоверно известно, что история чая
берёт своё начало в Древнем Ки ...
