С кислородомСтатьи / Получение молибдена из отходов промышленности / С кислородом
Литой и плотно спеченный слиток молибдена при нормальной и несколько повышенной температуре стоек к действию кислорода и воздуха [20]. При нагревании до темно-красного каления поверхность металла быстро тускнеет и при 600°С молибден загорается выделяя дым – возгон МоО3. Налет окисла легко разрушается и при длительном нагревании происходит полное сгорание металла до МоО3.
![]()
Молибденовый порошок окисляется при более низкой температуре, а мелкодисперсный порошок молибдена может самовозгораться на воздухе или в токе кислорода.
Рассмотрим ряд оксидов молибдена. Для молибдена были идентифицированы оксиды с химической формулой МоО3, и МоО2. Ковалентность молибдена в оксидах равна 3 и 2. Кроме того, получены оксиды промежуточного между МоО3 и МоО2 состава: Мо8О23, Мо9О26, Мо4О11, Мо17О47. характер связи в оксидах в основном ионный, частично ковалентный.
МоО и Мо2О3 не выделены в свободном состоянии, хотя ранее в литературе и упоминалось о их выделении [20, 23]. Рентгенографически идентифицирована фаза, содержащая кислород в количестве, соответствующему составу Мо3О. оксид МоО2 более тугоплавок и термодинамически устойчив чем оксид МоО3.
Поскольку молибден относится к металлам, то его оксиды должны проявлять основные свойства. Но оксиды МоО3, и МоО2 проявляют не основные свойства, а кислотные. Они дают ряд соединений общей формулой Н2МоО4 и Н2МоО3. основные свойства проявляет оксид Мо2О3.
МоО3 характерен гидрат состава Н2МоО4 и Н2МоО4 ×Н2О. Н2МоО4 - белые мелкие кристаллы гексагональной формы. Дигидрат Н2МоО4 × Н2О образуется при стоянии подкисленного раствора молибдатов в течении нескольких недель, а также при внесении затравки Н2МоО4 × Н2О в сильно подкисленный раствор парамолибдата аммония. Н2МоО4 - молибденовая кислота, кислота средней силы, например, она более сильная чем угольная кислота и вытесняет ее из ее солей:
![]()
Гидраты окислов с валентностью металла между VI и IV получены в виде соединений МоО(ОН)3 и Мо(ОН)5. сила этих электролитов очень слабая, они малорастворимы в воде.
МоО2 характерен гидрат состава Н2МоО3, который в свободном состоянии не выделен, выделен только в растворах, также получены его соединения состава Ме2МоО3. слабый электролит.
Также при действии аммиака на растворы молибдатов получен Мо(ОН)3 - аморфный порошок черного цвета, не растворим в воде и растворах щелочей, легко растворяется в минеральных кислотах и при отсутствии окислителей дает ионы Мо+3.
Рассмотрим свойства Н2МоО4
Молибденовая кислота реагирует при повышенной температуре с оксидами, гидроксидами, карбонатами щелочных и щелочноземельных металлов давая соответствующие молибдаты.
![]()
![]()
![]()
![]()
![]()
![]()
Состояние молибденовой кислоты в растворах зависит от кислотности и разбавлености последних. При большом разбавлении (<10-4 моль/л, РН>6,5) молибденовая кислота находится в растворе в виде простых молекул. В более концентрированных растворах и при РН меньше шести: РН<6 происходит полимеризация молекул. Степень сложности образованных комплексов также зависит от температуры.
Рассмотрим свойства Мо(ОН)3
Сухой Мо(ОН)3 - это аморфный порошок, не растворимый в воде и растворах щелочей. Он проявляет основные свойства. Легко растворяется в растворах минеральных кислот, при этом образуются соли Мо3+.
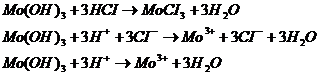
Смотрите также
Железо (Ferrum), Fe
Железо - Fe, химический элемент VIII группы периодической системы Менделеева; атомный номер 26, атомная масса 55,847; блестящий серебристо-белый металл. Элемент в природе состоит из четырёх стабильных ...
Спроектировать ректификационную установку для разделения бензол – толуол
...
Исследование свойств чая
Чай —
один из самых древних напитков, известных человечеству. Сегодня чай стал
неотъемлемой частью многих культур, однако достоверно известно, что история чая
берёт своё начало в Древнем Ки ...
