Примеры решения задачПериодическая система / Методика решения задач по теоретическим основам химической технологии / Примеры решения задач
1
. Во сколько раз увеличится скорость химической реакции при повышении температуры с 0 до 50°С, принимая температурный коэффициент скорости равным трем?
Решение:
В математической форме зависимость изменения скорости реакции от температуры выражается уравнением
![]() =
=
![]() γ
γ
![]()
Температура увеличивается на 50°С, а γ = 3. Подставляя эти значения, получим ![]() =
=
3![]() = 243
= 243
Ответ: скорость увеличится в 234 раза.
2.
Для реакции первого порядка А→2В определите время за которое прореагировало на 90% вещества А. Константа скорости реакции 1*10-4 с-1.
Решение:
А →
2В
![]() ;
; ![]() ;
;
C0,A- CA=0,9 C0,A
CA = 0,1 C0,A
k1t = lnC0,A- lnCA
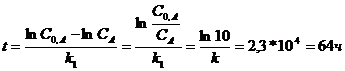 Ответ: 64 ч.
Ответ: 64 ч.
3
. Как изменится скорость реакции 2А+В2 ![]() 2АВ, протекающей и закрытом сосуде, если увеличить давление в 4 раза?
2АВ, протекающей и закрытом сосуде, если увеличить давление в 4 раза?
Решение:
По закону действия масс скорость химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ:
w=
![]() . Увеличивая в сосуде давление, мы тем самым увеличиваем концентрацию реагирующих веществ. Пусть начальные концентрации А и В равнялись [А] =а,
. Увеличивая в сосуде давление, мы тем самым увеличиваем концентрацию реагирующих веществ. Пусть начальные концентрации А и В равнялись [А] =а,
[В]=b. Тогда w=ka2b. Вследствие увеличения давления в 4 раза увеличились концентрации каждого из реагентов тоже в 4 раза и стали [A]=4a, [B]=4b.
При этих концентрациях w1 =k(4а)2 *4b = k64а2b. Значение kи обоих случаях одно и то же. Константа скорости для данной реакции есть величина постоянная, численно равная скорости реакции при молярных концентрациях реагирующих веществ, равных 1. Сравнивая w и w1, видим, что скорость реакции возросла в 64 раза. Ответ: скорость реакции возросла в 64 раза.
4
. Энергия активации некоторой реакции в отсутствие катализатора равна
76 кДж/моль и при температуре 27°С протекает с некоторой скоростью k1. В присутствии катализатора при этой же температуре скорость реакции увеличивается в 3,38 • 104 раз. Определите энергию активации реакции в присутствии катализатора.
Решение:
Константа скорости реакции в отсутствие катализатора запишется в виде
![]() = Ае
= Ае ![]() = Ae-30,485.
= Ae-30,485.
Константа скорости реакции в присутствии катализатора равна
![]() = Ае
= Ае ![]() = Ае
= Ае![]() .
.
По условию задачи
![]() =e – (- 30,485-
=e – (- 30,485-![]() )=3,38 * 104.
)=3,38 * 104.
Логарифмируем последнее уравнение и получаем
30,485 -![]() = 1n(3,38*104) = 10,43.
= 1n(3,38*104) = 10,43.
Отсюда Еа = 2493 • 20,057 = 50 кДж/моль.
Ответ: энергия активации реакции в присутствии катализатора равна 50 кДж/моль.
Смотрите также
Водород (Hydrogenium), Н
Водород - химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,00797. При обычных условиях В. - газ; не имеет цвета, запаха и вкуса.
Историческая ...
Полярные диаграммы и энергетические уровни волновых функций жесткого ротатора
...
Ртуть (Hydrargyrum), Hg
Каждому, кто хоть раз держал в руках термометр - "градусник", знакома ртуть. По своим химическим свойствам - это настоящий металл, но в отличие от других металлов жидкий при комнатной темпер ...
