Примеры решения задачПериодическая система / Методика решения задач по теоретическим основам химической технологии / Примеры решения задач
1
. Реакция соединения азота и водорода обратима и протекает по уравнению
N2 + 3Н2 ![]() 2NН3. При состоянии равновесия концентрации участвующих в ней веществ были: [N2] = 0,01 моль/л, [Н2] = 2,0 моль/л, [NH3] = 0,40 моль/л. Вычислить константу равновесия и исходные концентрации азота и водорода.
2NН3. При состоянии равновесия концентрации участвующих в ней веществ были: [N2] = 0,01 моль/л, [Н2] = 2,0 моль/л, [NH3] = 0,40 моль/л. Вычислить константу равновесия и исходные концентрации азота и водорода.
Решение:
Для приведенной реакции
![]()
Подставляя значение равновесных концентраций, получим
![]() = 2
= 2
Согласно уравнению реакции из 1 моль азота и 3 моль водорода получаем
2 моль аммиака, следовательно, на образование 0,4 моль аммиака пошло
0,2 моль азота и 0,6 моль водорода. Таким образом, исходные концентрации будут [N2] = 0,01 моль/л + 0,2 моль/л = 0,21 (моль/л),
[H2] = 2,0 моль/л + 0,6 моль/л = 2,6 (моль/л).
Ответ: Кравн = 2; С0 (N2) = 0,21 моль/л и С0 (Н2) = 2,6 моль/л.
2.
Один моль смеси пропена с водородом, имеющей плотность по водороду 15, нагрели в замкнутом сосуде с платиновым катализатором при 320°С, при этом давление в сосуде уменьшилось на 25%. Рассчитайте выход реакции в процентах от теоретического. На сколько процентов уменьшится давление в сосуде, если для проведения эксперимента в тех же условиях использовать 1 моль смеси тех же газов, имеющей плотность по водороду 16?
Решение:
С3Н6 + Н2 ![]() С3Н8
С3Н8
1) Пусть ν(C3H6) = х, ν(H2) =1-x, тогда масса смеси равна
42х + 2(1 - х) = 2 • 15 = 30,
откуда х = 0,7 моль, т. е. ν(C3H6) = 0,7 моль, ν(H2) = 0,3 моль.
Давление уменьшилось на 25% при неизменных температуре и объеме за счет уменьшения на 25% числа молей в результате реакции. Пусть у моль Н2 вступило в реакцию, тогда после реакции осталось:
ν(C3H6) = 0,7 - у, ν(H2) = 0,3 – у, ν(C3H8) = у,
νо6щ = 0.75 =(0,7 - у) + (0,3 - у) + у, откуда y = 0,25 моль.
Теоретически могло образоваться 0,3 моль С3Н8 (H2 — в недостатке), поэтому выход равен ![]() . Константа равновесия при данных условиях равна
. Константа равновесия при данных условиях равна
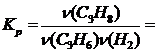
![]()
2) Пусть во втором случае ν(C3H6) = a моль, ν(H2) = (1 – а) моль, тогда масса смеси равна 42а + 2(1 - а) = 2 • 16 = 32, откуда, а= 0,75, т. е. ν(C3H6) = 0,75, ν(H2) = 0,25. Пусть в реакцию вступило b моль Н2. Это число можно найти из условия неизменности константы равновесия
![]() =
=![]()
Из двух корней данного квадратного уравнения выбираем корень, удовлетворяющий условию 0 < b < 0,25, т. е. b = 0,214 моль
Общее число молей после реакции равно
νoбщ =((0,75 - 0,214) + (0,25 - 0,214) + 0,214 - 0,786) моль, т. е. оно уменьшилось на 21,4% по сравнению с исходным количеством (1 моль). Давление пропорционально числу молей, поэтому оно также уменьшилось на 21,4%.
Ответ: выход С3Н8 — 83,3%; давление уменьшится на 21,4%.
Смотрите также
Производство азотной кислоты
Азотная кислота является одной из важнейших минеральных
кислот и по объему производства занимает второе место после серной кислоты. Она
образует растворимые в воде соли (нитраты), обладает н ...
Теория образования оксидов азота при горении
Условия образования оксидов при
горении до сих пор не разработаны в достаточной мере и требуют глубокой
проработки весьма сложной химической кинетики процесса в сочетании с детальным
изучен ...
