Химическое равновесиеПериодическая система / Методика решения задач по теоретическим основам химической технологии / Химическое равновесиеСтраница 1
При протекании химической реакции через некоторое время устанавливается равновесное состояние (химическое равновесие). Слово «равновесие» означает состояние, в котором сбалансированы все противоположно направленные на систему воздействия. Тело, находящееся в состоянии устойчивого равновесия, обнаруживает способность возвращаться в это состояние после какого-либо возмущающего воздействия.
Примером тела, находящегося в состоянии устойчивого равновесия, может служить шарик, лежащий на дне ямки. Если его толкнуть в одну или другую сторону, он вскоре снова возвращается в состояние устойчивого равновесия. В отличие от этого шарик, лежащий на краю ямки, находится в состоянии неустойчивого равновесия — достаточно ничтожного толчка, чтобы он необратимо скатился в ямку.
Оба этих примера являются примерами статического равновесия. В химии, однако, приходится сталкиваться не столько со статическими равновесиями, столько с динамическими («подвижными»). Динамическое равновесие устанавливается, когда оказываются сбалансированными два обратимых или противоположных процесса. Динамические равновесия подразделяют на физические и химические. Наиболее важными типами физических равновесий являются фазовые равновесия. Система находится в состоянии химического равновесия, если скорость прямой реакции равна скорости обратной реакции.
Например, если скорость протекания реакции (константа скорости к1)
k1
А(г) + В(пар) ![]() АВ(г)
АВ(г)
равна скорости обратной реакции (константа скорости k2)
k2
АВ(г)![]() А(г) + В(пар)
А(г) + В(пар)
то система находится в динамическом равновесии. Подобные реакции называются обратимыми, а их уравнения записывают с помощью двойной стрелки:
k1
А(г) + В(пар) ![]() АВ(г)
АВ(г)
k2
Реакции, протекающие слева направо, называются прямой, справа налево – обратной.
Нужно подчеркнуть, что реакционная система остается в состоянии динамического равновесия лишь до тех пор, пока система остается изолированной. Изолированной называют такую систему, которая не обменивается с окружающей средой ни веществом, ни энергией.
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции общего вида
k1
аA +bB ![]() сC + dD (1.2.1)
сC + dD (1.2.1)
k2
константа равновесия К
, представляющая собой отношение констант скорости прямой и обратной реакций, запишется
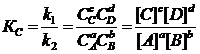 (1.2.2)
(1.2.2)
где, Кс– константа скорости реакции, зависящая от концентрации реагирующих компонентов; Сi
или [ i ]-
равновесная молярная концентрация i-того компонента;
a, b, c, d
– стехиометрические коэффициенты веществ.
В правой части уравнения (1.2.2) стоят концентрации взаимодействующих частиц, которые устанавливают при равновесии, - равновесные концентрации.
Уравнение (1.2.2) представляет собой математическое выражение закона действующих масс при химическом равновесии. Для реакции с участием газов константа равновесия выражается через парциальные давления, а не через их равновесные концентрации. В этом случае константу равновесия обозначают символом Кр.
![]()
Рi
- равновесные парциальные давления i-того компонента.
Сi
- равновесная молярная концентрация компонентов.
a, b, c, d
–
стехиометрические коэффициенты веществ.
Состояние химического равновесия при неименных внешних условиях теоретически может сохраняться бесконечно долго. В реальной действительности, т.е. при изменении температуры, давления или концентрации реагентов, равновесии может «сместиться» в ту или иную сторону протекания процесса.
Изменения, происходящие в системе в результате внешних воздействий, определяется принципом подвижного равновесия – принципом Ле Шателье – Брауна. При воздействие на равновесную систему, любого внешнего фактора, равновесие в системе смещается в таком направлении, чтобы уменьшить воздействие этого фактора.
1.
Влияние давления на равновесие химической реакции (для реакции, проходящей в газовой фазе).
Смотрите также
Рентгенофлуоресцентное определение редких элементов Sr, Rb, Nb в литий-фтористых редкометальных гранитах
Научный и практический интерес к литий-фтористым редкометальным
гранитам обусловлен уникальностью их химического и минерального состава, а
также экстремальными (вплоть до рудных) концентраци ...
Масс-спектрометрический метод анализа
Масс-спектрометрию
описывали как мельчайшие весы в мире, не из-за размера масс-спектрометра, но
из-за того, что он взвешивает – молекулы. За последнее время масс-спектрометрия
претерпела по ...
