Метод валентных связейПериодическая система / Метод валентных связейСтраница 1
Валентных связей метод (метод валентных схем), метод приближенного решения электронного уравнения Шрёдингера для многоэлектронных молекулярных систем. Основан на представлениях о двухцентровых химических связях между атомами в молекуле, образуемых двумя электронами. Эти представления являются обобщением на многоатомные молекулы приближения Гайтлера - Лондона, позволившего впервые с помощью квантовомех. методов объяснить хим. связь в молекуле Н2.
Осн. физ. идея В. с. м. состоит в том, что волновая ф-ция молекулы выражается через волновые ф-ции составляющих ее атомов. Образование хим. связи рассматривается как результат спаривания спинов своб. электронов атомов. Тем самым В. с. м. дает обоснование одному из осн. положений теории валентности: валентность нейтрального атома равна числу своб. электронов в его валентной оболочке. Каждому валентному штриху, соединяющему атомы А и В в структурной ф-ле молекулы, отвечает двухэлектронная ф-ция валентной связи ХАВ(1,2), к-рая представляется в виде произведения двух волновых ф-ций: пространственной Ф(1,2), симметричной относительно перестановки координат электронов, и спиновой![]() (1,2), антисимметричной относительно такой перестановки и описывающей систему двух электронов с противоположными спинами; цифры 1 и 2 в этих обозначениях указывают пространств. координаты или спиновые переменные первого и второго электронов либо те и другие одновременно. Следовательно,
(1,2), антисимметричной относительно такой перестановки и описывающей систему двух электронов с противоположными спинами; цифры 1 и 2 в этих обозначениях указывают пространств. координаты или спиновые переменные первого и второго электронов либо те и другие одновременно. Следовательно,
![]()
Для простейшей молекулы Н2 ф-цию Ф(1,2) строят из 1s-орбиталей атомов Н, обозначаемых для разных ядер как![]() и
и![]() , а ф-цию
, а ф-цию![]() (1,2) - из одноэлектронных спиновых ф-ций
(1,2) - из одноэлектронных спиновых ф-ций![]() и
и![]() (спин-функций), описывающих состояния электронов с противоположно направленными спинами:
(спин-функций), описывающих состояния электронов с противоположно направленными спинами: 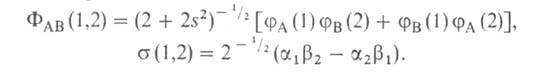
Энергия молекулы![]() , рассчитанная с такой двухэлектронной волновой ф-циеи Х(1,2), равна:
, рассчитанная с такой двухэлектронной волновой ф-циеи Х(1,2), равна:
![]()
где ЕH-энергия атома Н,![]() -интеграл перекрывания орбиталей (dV- элемент объема в пространстве координат одного электрона), I и К -т. наз. кулоновский и обменный интегралы соответственно. Кулоновский интеграл учитывает вклад в энергию связи, обусловленный электростатич. взаимод. неискаженных электронных облаков атомов между собой и с ядром соседнего атома, обменный - вклад, обусловленный деформацией электронного облака при образовании связи и перемещением его в пространство между ядрами (> 90% энергии связи); см. также Молекулярные интегралы.
-интеграл перекрывания орбиталей (dV- элемент объема в пространстве координат одного электрона), I и К -т. наз. кулоновский и обменный интегралы соответственно. Кулоновский интеграл учитывает вклад в энергию связи, обусловленный электростатич. взаимод. неискаженных электронных облаков атомов между собой и с ядром соседнего атома, обменный - вклад, обусловленный деформацией электронного облака при образовании связи и перемещением его в пространство между ядрами (> 90% энергии связи); см. также Молекулярные интегралы.
Смотрите также
Татарстан - республика химии
...
Модификация вторичных полимеров для изготовления изделий различного функционального назначения
...
Резерфордий (Rutherfordium), Rf
Резерфордий - искусственно полученный радиоактивный химический элемент IV группы периодической системы Менделеева, атомный номер 104. Известны только радиоактивные изотопы: 260Rf и 259Rf (периоды полу ...
