Ядро атома химического элементаМатериалы / Ядро атома химического элементаСтраница 1
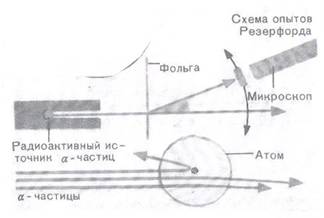
Ядро атома обнаружил в 1909-1911 годах Эрнест Резерфорд, изучая природу радиоактивности. Более того, он доказал экспериментально существование ядра атома, «обстреливая» α-частицами фольгу из золота, которая была настолько тонкой, что могла висеть в воздухе и пропускала свет.
 Смотрите описание печать флаеров недорого на сайте.
Смотрите описание печать флаеров недорого на сайте.
По расчетам Э.Резерфорда атом, размеры которого не более 10-6нм, имеет ядро диаметром порядка 10-10нм.
В 1913 году Г. Мозли установил, что заряд ядра атома равен порядковому номеру химического элемента в таблице Д.И. Менделеева.
И, наконец, открытие Э. Резерфордом в 1920 году протона, а Дж. Чедвиком в 1922 году нейтрона предложили простейшую модель строения атома:
1) В центре атома находится положительно заряженное ядро, занимающее ничтожную часть внутреннего пространства атома (радиус ядра атома водорода равен 6,5 * 10-7нм).
2) Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3) Ядра атомов состоят из протонов и нейтронов (общее название – нуклоны)
Ядро простейшего атома – атома водорода – состоит из одного протона. Ядра всех остальных атомов состоят из протонов и нейтронов.
Протонно – нейтронная модель ядра атома была предложена в 1932 году одновременно и независимо советским физиком Д.Д. Иваненко и В. Гейзенбергом.
Протон обладает массой ( он в 1836,12 раз массивнее электрона), положительным зарядом, равным по абсолютной величине заряду электрона, имеет спин (s=1/2) и собственный магнитный момент. Собственный магнитный момент протона в 660 раз меньше магнитного момента электрона.
Нейтрон электрического заряда не имеет, его масса близка к массе протона, но немного больше. Нейтрон обладает спином (s=1/2) и собственным магнитным моментом.
В свободном состоянии нейтрон нестабилен (радиоактивен). Он самопроизвольно распадается, превращаясь в протон, испуская электрон (е-) и частицу, называемую антинейтрино. Масса антинейтрино равна нулю.
******
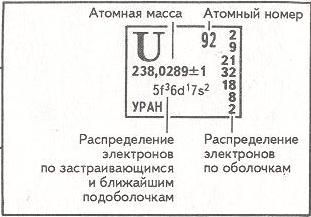
Одной из важнейших характеристик атомного ядра является зарядовое число «Z». Оно равно количеству протонов, входящих в состав ядра, и определяет его заряд, который равен Z * е+ (е – это абсолютная величина заряда электрона). Число «Z» определяет порядковый номер химического элемента в периодической таблице Д.И. Менделеева, поэтому его называют атомным номером ядра атома химического элемента.
Число нуклонов (суммарное число протонов и нейтронов) в ядре атома обозначается буквой «А» и называется массовым числом ядра атома.
Число нейтронов равно «N» (N=А-Z).
Обозначение ядер атомов химических элементов приведено в таблице Д.И. Менделеева.
Ядра атомов с одинаковым значением числа Z, но с разными значениями числа А, называется изотопами. Большинство химических элементов имеют по несколько изотопов. Например, кислород имеет три изотопа, олово – 10 изотопов и т.д.
Ядра с одинаковым массовым числом «А» называются изобарами. Например, аргон Ar и кальций Са.
Ядра с одинаковым числом нейтронов N=A-Z носят название изотонов. Например, углерод-13 и азот-14.
В природе встречаются химические элементы с атомным номером Z от 1 до 92, исключая технеций (Tc, Z=43) и прометий (Pm, Z=61). Плутоний (Pu, Z=94), после получения его искусственным путем, был обнаружен в ничтожных количествах в природном минерале – смоляной обманки. Остальные трансурановые (следующие в таблице Дмитрия Ивановича Менделеева за ураном) элементы (с Z от 93 до 107 и далее) были получены искусственным путем.
********
Все попытки построения теории ядра атома наталкиваются на две серьёзные трудности:
1) Недостаточность знаний о силах, действующих между нуклонами ядра атома.
2) Чрезвычайную громоздкость квантовой задачи многих тел (ядро атома с массовым числом А представляет собой систему из А тел).
Эти трудности вынуждают идти по пути создания ядерных моделей, позволяющих описывать сравнительно простыми математическими средствами, определенную совокупность свойств ядер атома.
Но ни одна из подобных моделей не может дать исчерпывающего описания ядра атома. Приходится пользоваться несколькими моделями, каждая из которых подбирается так, чтобы получить согласие с экспериментом. Все модели ядра атома описать невозможно, но две из них наиболее известны.
*******
Капельная модель ядра атома была предложена советским ученым Я.И. Френкелем в 1939 году, и развита затем Н. Бором, другими учеными.
Я.И Френкель обратил внимание на сходство атомного ядра с капелькой жидкости. Сходство заключается в том, что в обоих случаях силы, действующие между частицами, - молекулами в жидкости и нуклонами в ядре атома, - являются короткодействующими (действующими на очень близких расстояниях). Кроме того, практически одинаковая плотность вещества в разных ядрах свидетельствуют о крайне малой сжимаемости ядерного вещества. С той же малой сжимаемостью обладают и жидкости. Указанное сходство дало основание уподобить ядро атома заряженной капельке жидкости.
Смотрите также
Строение и свойства полимеров
Полимерные
вещества внедрились во все сферы человеческой деятельности – технику,
здравоохранение, быт. Ежедневно мы сталкиваемся с различными пластмассами,
резинами, синтетическими волокнам ...
Медь и её природные соединения, синтез малахита
Синтезировать
5 г. Малахита, рассчитать практический выход продукта, научиться пользоваться
необходимой литературой, выбирать из неё необходимую информацию, и представлять
полученные резуль ...
