Химическое равновесиеПериодическая система / Лекции по коллоидной химии / Химическое равновесиеСтраница 2
По мере уменьшения концентрации исходных веществ растет концентрация продуктов реакции; соответственно, скорость прямой реакции уменьшается, скорость обратной реакции увеличивается. Очевидно, что через некоторое время скорости прямой и обратной реакции сравняются, после чего концентрации реагирующих веществ перестанут изменяться, т.е. установится химическое равновесие.
Приняв, что V1 = V2, можно записать:
![]() (I.83)
(I.83)
![]() (I.84)
(I.84)
Т.о., константа равновесия есть отношение констант скорости прямой и обратной реакции. Отсюда вытекает физический смысл константы равновесия: она показывает, во сколько раз скорость прямой реакции больше скорости обратной при данной температуре и концентрациях всех реагирующих веществ, равных 1 моль/л.
Теперь рассмотрим (с некоторыми упрощениями) более строгий термодинамический вывод выражения для константы равновесия. Для этого необходимо ввести понятие химический потенциал. Очевидно, что величина свободной энергии системы будет зависеть как от внешних условий (T, P или V), так и от природы и количества веществ, составляющих систему. В случае, если состав системы изменяется во времени (т.е. в системе протекает химическая реакция), необходимо учесть влияние изменения состава на величину свободной энергии системы. Введем в некоторую систему бесконечно малое количество dni молей i-го компонента; это вызовет бесконечно малое изменение термодинамического потенциала системы. Отношение бесконечно малого изменения величины свободной энергии системы к бесконечно малому количеству компонента, внесенному в систему, есть химический потенциал μi данного компонента в системе:
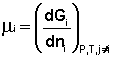 (I.85)
(I.85)
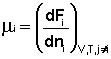 (I.86)
(I.86)
Химический потенциал компонента связан с его парциальным давлением или концентрацией следующими соотношениями:
![]() (I.87)
(I.87)
![]() (I.88)
(I.88)
Здесь μ°i – стандартный химический потенциал компонента (Pi = 1 атм., Сi = 1 моль/л.). Очевидно, что изменение свободной энергии системы можно связать с изменением состава системы следующим образом:
![]() (I.89)
(I.89)
![]() (I.90)
(I.90)
Поскольку условием равновесия является минимум свободной энергии системы (dG = 0, dF = 0), можно записать:
![]() (I.91)
(I.91)
В закрытой системе изменение числа молей одного компонента сопровождается эквивалентным изменением числа молей остальных компонентов; т.е., для приведенной выше химической реакции имеет место соотношение:
![]() (I.92)
(I.92)
Отсюда можно получить следующее условие химического равновесия в закрытой системе:
![]() (I.93)
(I.93)
В общем виде условие химического равновесия можно записать следующим образом:
![]() (I.94)
(I.94)
Выражение (I.94) носит название уравнения Гиббса – Дюгема. Подставив в него зависимость химического потенциала от концентрации, получаем:
![]() (I.95)
(I.95)
Поскольку Σniμi= ΔF
, а Σniμ°i
= ΔF°
, получаем:
![]() (I.96)
(I.96)
Смотрите также
Задание 2
1.Какие вещества вступили в реакцию, если в результате образовались
следующие вещества (указаны все продукты реакции без коэффициентов). Напишите
уравнения соответствующих реакций.
а) Fe2(SO4)3+S ...
Прогнозирование критического давления. Основные методы прогнозирования
...
