Теоретическая часть.Периодическая система / Ламарк Жан Батист Пьер Антуан де Моне / Теоретическая часть.Страница 1
Раздел химии, изучающий скорость и механизм протекания физико-химических процессов, называется химической кинетикой. Кинетика позволяет выяснить реальные механизмы протекания процессов. В химической кинетике различают гомогенные и гетерогенные процессы.
Гомогенные процессы протекают во всем объёме, и реагирующие вещества находятся в одной фазе. В этом случае молекулы реагирующих веществ находятся в одинаковых условиях. Гетерогенные процессы протекают на границе раздела фаз.
Скоростью физико-химического процесса называется изменение количества реагирующих веществ в единицу времени в единице реакционного пространства. Реакционным пространством в гомогенной системе служит объем сосуда, в котором происходит взаимодействие, в гетерогенной – поверхность раздела фаз. Формулы для средних скоростей этих процессов имеют вид:
Dn Dn
Vгом=±------- ; Vгетер=±------
nDn SDt
где, Dn = n2 – n1 , Dt = t2 - t1.
n2 и n1 – количество молей изменяющегося в реакции вещества в моменты времени t2 и t1. n - объем реакционного пространства, S – площадь границы раздела двух сред.
Скорость физико-химических процессов величина положительная, поэтому перед дробью ставят знак ±. Измеряется : моль/л*с, моль/м²*с.
Количество вещества отнесенное к занимаемому объему есть мольная концентрация. Т.е. скорость гомогенной реакции есть изменение концентрации одного из реагирующих веществ в еденицу времени:
C2 – C1 DC
Vгом = ±------- = ± -----
t2 - t1 Dt
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры, давления, присутствия в системе католизаторов и т.д.
Закон действия масс: скорость гомогенной химической реакции при постоянной температуре прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакций.
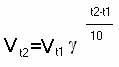 |
где Vt1 и Vt2 – скорости реакции соответственно при конечной t2 и начальной t1 температурах, g - температурный коэффициент скорости (от 2 до 4), показывающий, во сколько раз возрастает скорость реакции с повышением температуры реагирующих веществ на 10°. Одним из наиболее распространенных способов изменения скорости является катализ. Катализ может быть гомогенным (реагенты и катализатор в одной фазе) и гетерогенным (реагент и катализатор в разных фазах)
Все физико-химические процессы можно разделить на обратимые и необратимые.
Состояние процесса, при котором скорости прямой и обратной реакции равны, называется химическим равновесием.
Для обратимой реакции: aA + bB « cC + dD, в состоянии равновесия выполняется следущее соотношение:
CC * CD PC * PD
KC = --------- или Kp = --------
CA * CB PA * PB
Смотрите также
Кадмий (Cadmium), Cd
Кадмий - химический элемент II группы периодической системы Менделеева; атомный номер 48, атомная масса 112,40; белый, блестящий, тяжёлый, мягкий, тягучий металл. Элемент состоит из смеси 8 стабильных ...
Рутений (Ruthenium), Ru
Рутений — химический элемент с атомным номером 44 в периодической системе, обозначается символом Ru (лат. Ruthenium), Серебристо-серый хрупкий переходный металл, благородный металл.
Значительным ...
